Aktuelle Konzepte zu ektopen Lymphknoten-Einschlüssen unter besonderer Berücksichtigung nodaler Nävi
Zusammenfassung
Einschlüsse ektopen Gewebes in Lymphknoten sind recht häufige Befunde in Dermatopathologie und allgemeiner Pathologie. In den Lymphknoten finden sich glanduläre und nicht-glanduläre Epithelien, aber auch melanozytäre Nävi. Meist handelt es sich um Zufallsbefunde ohne Relevanz. Bei der Beschreibung morphologischer Befunde ist es allerdings wichtig, solche benignen Einschlüsse von metastatischen Absiedlungen bestimmter Organtumoren sicher abzugrenzen. Biopsien des „Wächterlymphknotens“ und Lymphknotendissektionen sind heute Standard in der klinischen Onkologie und haben erhebliche Auswirkungen auf den Behandlungsverlauf. Nodale Einschlüsse müssen korrekt bestimmt werden, um eine Über- oder Unterbehandlung der Patienten zu vermeiden. Hinzu kommt, dass die Entstehung solcher Einschlüsse noch nicht ausreichend geklärt ist. Derzeit existieren zwei Konzepte - die Theorie der benignen Metastasen und die Theorie der unterbrochenen Migration. Allerdings konnte bisher keine der beiden Theorien die folgenden Fragen beantworten: Warum finden wir mehr nodale Nävi bei Melanompatienten, bei denen eine Biopsie des Wächterlymphknotens vorgenommen wurde, als bei Patienten ohne Melanom? Und warum gibt es in tiefen viszeralen Lymphknoten keine nodalen Nävi? Wir geben hier einen umfassenden Überblick über nodale Einschlüsse und präsentieren eine Theorie der Pathogenese nodaler Nävi, um die obengenannten Fragen zu beantworten.
Einleitung
Die Begriffe „Ektopie“ und „Heterotopie“ werden synonym verwendet. Wir verstehen darunter alle Gewebe und Organe, die außerhalb ihrer normalen Lokalisierung im Körper nachweisbar sind. Beispiele sind etwa die Ektopie der Magenschleimhaut, die Endometriose, die Deziduose oder die Extrauterinschwangerschaft [1]. Ektopes Gewebe findet sich häufig in Lymphknoten. Im Laufe der letzten Jahrzehnte sind Lymphknotenexzision und Untersuchung der „Wächterlymphknoten“ beim Mikro-Staging maligner Tumoren unentbehrlich geworden. Die Kenntnis aberranter Einschlüsse in Lymphknoten ist daher wichtig, um zwischen Mikrometastasen und benignen ektopen Einschlüssen sauber unterscheiden zu können. Diese Arbeit gibt – mit dermatopathologischem Schwerpunkt – einen Überblick über die unterschiedlichen nodalen Einschlüsse und definiert differenzialdiagnostisch wichtige Kriterien. Der Artikel diskutiert pathophysiologische Aspekte nodaler Einschlüsse, insbesondere Morphologie und Immunhistochemie nodaler melanozytärer Nävi. Danach wird das Thema aus molekulargenetischer Sicht beleuchtet.
Allgemeine Aspekte aberranter Einschlüsse – was ist in Lymphknoten alles zu finden?
Grundsätzlich wird zwischen epithelialen, glandulären und nicht-epithelialen Einschlüssen in Lymphknoten unterschieden. Nicht-glanduläre Einschlüsse sind wesentlich seltener. Manche Tumoren besiedeln bevorzugt bestimmte Lymphknotenstation. Nävuszellen sind üblicherweise in zervikoaxillären und inguinalen Lymphknoten nachzuweisen [2]; Dezidua, meist in intraabdominalen Lymphknoten, kann mit Metastasen eines Plattenepithelkarzinoms verwechselt werden [3-5], und eine nodale Leiomyomatose in abdominalen Lymphknoten wird manchmal als disseminierte peritoneale Leiomyomatose oder uterines Leiomyom fehlinterpretiert [6, 7]. Benigne Einschlüsse in axillären Lymphknoten sind die häufigste Ursache für falsch-positive Diagnosen bei Biopsien der Wächterlymphknoten (SNLB, sentinel lymph node biopsies) oder bei Lymphknotendissektionen [8].
Außer glandulären und nicht-glandulären Einschlüssen sind auch andere Materialien in Lymphknoten zu finden. Pulitzer et al. beschrieben Material einer solaren Elastose in dermalen Lymphgefäßen und Lymphknoten; dieses Material war in den Kapseln, den subkapsulären Sinus sowie dem Parenchym der Lymphknoten von neun Patienten lokalisiert – acht mit Melanom und einer mit Merkelzellkarzinom. Die Autoren fanden das elastotische Material in Lymphknoten beim metastasierten Melanom, in nodalen Nävi und in Lymphknoten ohne extrinsische Zellen [15].
Pulitzer et al. haben bereits das Paradigma der allgemeinen Pathologie kritisch diskutiert: Extrinsische Zellen oder heterotopes Gewebe in Lymphknoten lassen sich nicht vom metastatischen Stadium maligner Tumoren unterscheiden. Daher postulieren sie für solche Fälle benigne und klinisch nicht relevante, passive nodale „Metastasen“ [15].
Die diagnostische Herausforderung besteht darin, benigne nodale Einschlüsse von Metastasen primärer solider Tumoren wie Melanomen oder Mammakarzinomen zu unterscheiden. Fehldiagnosen können zu ausgedehnten Operationen, inadäquatem Staging und Übertherapie führen [8]. Bei glandulären Einschlüssen im Lymphknoten gelingt die morphologische Differenzierung, wenn in der Ursprungsdrüse kein Karzinom vorhanden ist, durch morphologisch normales Epithel, fehlende Atypien oder mitotische Aktivität, überwiegend intrakapsuläre Lage weniger Drüsen, und Abwesenheit von Desmoplasien [2].
Die Endosalpingiose bildet am häufigsten glanduläre Einschlüsse und ist ein Beispiel für glanduläre Lymphknoten-Einschlüsse mit typischer Lokalisation. Sie ist häufig (bei 5–41 % der Frauen) in Becken- und retroperitonealen Lymphknoten, tritt supradiaphragmatisch aber selten auf [8]. Endosalpingiose in axillären und inguinalen Lymphknoten wurde sehr selten beobachtet [2, 8]. Sampson hat den Begriff der Endosalpingiose im Jahr 1930 geprägt [23]; es handelt sich um heterotop versprengtes glanduläres Epithel der Müllerschen Gänge, das sich zu Eileiter-Epithel differenziert [8]. Auch die Begriffe „paramesonephrisch“ oder „Müller-Einschlüsse mit Epithel des tubulären Typs“ werden synonym verwendet [24]. Bei der Endometriose findet sich entsprechendes Stroma-Gewebe, und wenn auch glatte Muskelzellen nachzuweisen sind, sprechen wir von Endomyometriose [24, 25].
Einschlüsse mesothelialer Zellen sind außerordentlich selten und finden sich am ehesten in infradiaphragmatischen Lymphknotenstationen, also mediastinal, para-aortal, inguinal und im Becken [2]. Speicheldrüsen- und Schilddrüsenfollikel hingegen treten in zervikalen Lymphknoten [14, 26], Drüsengewebe des Dickdarms und Nierengewebe auf [15, 27, 28]. Intranodale Einschlüsse mesothelialer Zellen sind of assoziiert mit Hyperplasie und Entzündung der betroffenen serösen Membranen, erkennbar an begleitenden Ergüssen. Mesotheliale Zellen imitieren Sinus-Histiozytosen oder metaplastische Karzinome, die Struktur des Lymphknotens ist jedoch nicht beeinträchtigt [2].
Die Differentialdiagnosen heterotoper nodaler Einschlüsse mesothelialen Gewebes in der allgemeinen Pathologie unterscheiden sich aufgrund der zugrundeliegenden Histogenese des ursprünglichen Gewebes. Verschiedene immunhistologische Färbungen ermöglichen die Unterscheidung [2]. Zu den Differentialdiagnosen nodaler mesothelialer Einschlüsse zählen metastasierte Melanome (S100+, HMB45+), nodale melanozytäre Nävi (S100+, HMB45-) sowie Karzinome, insbesondere schwere Borderline-Tumoren mit subkapsulär-sinusoidalem Befallsmuster (Cytokeratin+, MOC-31-Antikörper+, auch epithelspezifisches Antigen/Ep-CAM genannt) [2, 29, 30]. Weitere Differentialdiagnosen sind anaplastisch-großzellige Lymphome (die ebenfalls mit epithelialen Markern anzufärben sind) [31, 32] sowie – als größte Herausforderung – metastasierte Mesotheliome [33]. Da die Immunhistochemie keine Unterscheidung zwischen benigne und maligne erlaubt, kommt es bei der Unterscheidung zwischen benignen mesothelialen Zellen und metastasierten Mesotheliomen auf ganz bestimmte Kriterien an; diese Unterscheidung kann äußerst schwierig sein. Es ist interessant, dass Mesotheliome meist keine ausgeprägte Atypie zeigen während benigne Einschlüsse mit Atypien und mitotischer Aktivität einhergehen können [34, 35]. Eine zytologische Untersuchung oder Biopsie der verdächtigen mesothelialen Oberflächen kann bei der Abgrenzung der beiden Typen helfen [2].
Nodale melanozytäre Einschlüsse – nodale melanozytäre Nävi
- ▸ Intraparenchymatöser Nävus bei einem Patienten mit invasivem Melanom
- ▸ Nodaler Nävus neben einer Melanom-Mikrometastase im selben Wächterlymphknoten
- ▸ Nodaler blauer Nävus bei einem Patienten mit malignem Melanom
Nach unserer Auffassung fehlt in dieser Liste eine vierte Kategorie nodaler melanozytärer Einschlüsse: Solche, die bei radikaler Lymphknotendissektion wegen anderer Tumoren gefunden werden, etwa Mammakarzinomen oder Plattenepithelkarzinomen im Kopf- und Halsbereich. Auch bei diesen Tumoren finden sich Lymphknoten mit Nävus-Komplexen, wenn auch viel seltener als in den Wächterlymphknoten bei Patienten mit Melanom [38, 39].
Trotz gut definierter morphologischer Kriterien und moderner immunhistochemischer Färbemethoden gestaltet sich die Differenzierung der NMN vom metastasierten Melanom im individuellen Fall äußerst schwierig oder ist sogar ganz unmöglich. Dies trifft insbesondere auf nodale Einschlüsse von blauen Nävi zu. Schon beim primären Tumor an der Haut ist die Unterscheidung zwischen benigne und maligne oft schwierig, so dass eine Restunsicherheit verbleibt. In solchen Fällen muss unbedingt eine zweite dermatopathologische Meinung eingeholt werden. Wenn ein nodaler melanozytärer Einschluss nicht richtig interpretiert wird, kann das eine unzureichende Behandlung oder auch eine Übertherapie des Patienten zur Folge haben, und dies gilt es zu vermeiden. Um die Dignität einer nodalen Zellproliferation zuverlässig beurteilen zu können, empfiehlt sich der Vergleich der nodalen Zellmorphologie mit der in der primären Läsion. Wenn Morphologie und Immun-Phänotyp in Primärtumor und nodalem Infiltrat übereinstimmen, ist es sehr wahrscheinlich, dass es sich bei der Läsion im Lymphknoten um ein Infiltrat der Primärläsion handelt. Dies gilt sowohl für Melanom-Metastasen als auch für „Relokationen“ eines angeborenen Nävuszell-Nävus [39, 40].
Lokalisation nodaler melanozytärer Nävi
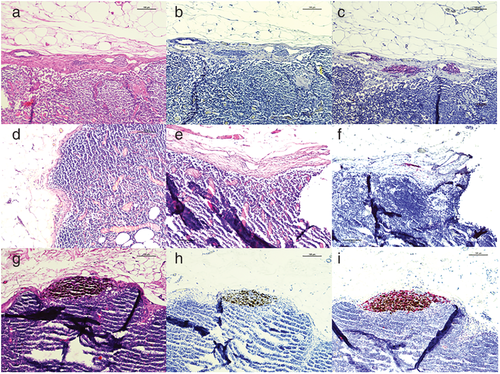
Abbildung 1d zeigt den normalen Kapselbereich eines subkutanen Lymphknotens mit zarter fibröser Kapsel und einigen Histiozyten im subkapsulären Sinus. Nodale melanozytäre Nävi finden sich hauptsächlich innerhalb der fibrösen Kapsel und der Trabekel, nur selten aber im nodalen Parenchym und den Sinusoiden oberflächlicher hautdrainierender Lymphknoten (Abbildung 1a–c und g–i). Auch in perinodalen Gefäßen sind nodale Nävi bekannt [41, 42]. Ogawa et al. konnten Anteile eines NMN im Lymphknotenhilus nachweisen [43]. Aufgrund eines Mammakarzinoms wurde eine axilläre Lymphadenektomie durchgeführt; zu diesem Zeitpunkt war von einem Melanom nichts bekannt. Der Komplex melanozytärer Zellen, der zunächst intraparenchymal zu liegen schien, wurde initial als Metastase eines Melanoms diagnostiziert. Erst nach weiterer immunhistochemischer Diagnostik und umfangreicher dermatologischer Untersuchung der Patientin wurde die Dianose eines nodalen Nävus in den Stufenschnitten des Lymphknotenhilus gestellt [43].
NMN finden sich typischerweise in oberflächlichen Lymphknoten; tiefe Lymphknoten in Abdomen und Becken haben solche Einschlüsse nicht [10, 11, 39, 44]. Die Lokalisation der NMN ist ein „weiches“, aber sehr wichtiges Kriterium für die Differenzierung zwischen benignen Nävi und metastasierten nodalen Melanomen [37]. Obwohl eine trabekuläre oder kapsuläre Lokalisation als Kriterium für Gutartigkeit gilt, muss bei melanozytären Zellen im Lymphknotenparenchym stets auch ein metastasiertes Melanom erwogen werden.
Eine Studie von Biddle et al. beschreibt 13 Patienten, bei denen aufgrund maligner Erkrankungen eine Halsdissektion sowie eine Exstirpation axillärer und inguinaler Lymphknoten durchgeführt wurde [39]. Bei den Malignomen handelte es sich teils um Melanome, teils um Mammakarzinome, Tonsillenkarzinome und Adnexkarzinome. Bei allen Patienten waren in allen erwähnten Lymphknotenstationen individuelle Lymphknoten mit Nävuszell-Aggregaten im Parenchym entdeckt worden. Mitosen wurden nicht festgestellt, ebenso fanden sich keine ausgeprägten Vakuolen oder Befall der Lymphgefäße [39].
Inzidenz nodaler melanozytärer Nävi (NMN) und ihre Verbindung zu kongenitalen kutanen Nävi
Die Inzidenz von NMN bei Patienten mit benignen und malignen Erkrankungen liegt bei 1–22 % [9-12]; dabei finden sich NMN in den Lymphknoten von Patienten mit Melanomen häufiger als bei Patienten mit Mamma- oder Prostatakarzinomen [11]. In einer sehr umfangreichen Datenanalyse von 11.274 Patienten fanden de Beer et al. eine Inzidenz von 5 % NMN in den Wächterlymphkoten [45]. Holt et al. fanden Unterschiede in der Inzidenz von NMN in den Wächterlymphknoten von Melanompatienten (3,9 %) und der Inzidenz in sonstigen Lymphknoten bei Melanompatienten (1 %) [11]. NMN zeigen eine signifikante Korrelation mit der Dicke der malignen Melanome von mehr als 2,5 mm nach Breslow und sind außerdem mit kutanen Nävi assoziiert (75 %), besonders mit kongenitalen Nävi (19 %) [11]. In Lymphknoten von Melanompatienten, die keine Wächterlymphknoten sind, finden sich gewöhnlich keine nodalen melanozytischen Nävi [11].
Bei Melanomen in räumlicher Nähe zu kongenitalen melanozytären Nävi ist die Inzidenz von NMN höher [9-11]. Solche NMN sind häufiger, wenn Melanome sich aus bestehenden Nävi entwickeln, als in Fällen de novo entstandener Melanome. Das gilt auch, wenn kleine kongenitale Nävi im entsprechenden Abflussgebiet der Haut lokalisiert sind [9, 10].
Die erste Beschreibung von Stewart und Copeland handelte von einem nodalen Nävus bei einem Patienten, dessen Melanom sich aus einem großen kongenitalen Nävus entwickelt hatte und der gleichzeitig eine Neurofibromatose aufwies [36]. Im Jahr 1974 publizierten McCarthy et al. eine Fallserie über NMN, die mit kutanen Nävi assoziiert waren – wobei die Assoziation extrem hoch war: 21 der 22 Patienten mit kongenitalen Nävi wiesen NMN in den entsprechenden regionalen Hautarealen auf [44]. In den beiden Serien von Fontaine et al. (2002) und Carson et al. (1996) fand sich eine signifikante Assoziation von NMN und kongenitalen kutanen Nävi in räumlicher Nähe zu primären Melanomen [9, 10]. Carson et al. berichteten, dass 40 % aller Lymphknoten von Patienten mit Melanomen, die auf Nävi entstanden, auch NMN-Einschlüsse aufwiesen. Bei Patienten mit de novo–Melanomen fanden sich NMN-Komplexe nur in 20 % der Lymphknoten [9]. Fontaine et al. zeigten eine signifikante Assoziation zwischen kutanen Nävi in den entsprechenden Hautarealen mit NMN, ebenso eine signifikante Assoziation von kongenitalen Nävi und nodalen Nävi [10].
Besonders gelagert sind Lymphknotenexstirpationen bei Patienten mit großen bis riesigen kongenitalen Nävi; diese Patienten haben ein signifikant erhöhtes Risiko für maligne Melanome, die sich im kongenitalen Nävus entwickeln können [46, 47]. Es existieren einige Berichte zu NMN bei Patienten mit Melanomen, die sich aus kongenitalen Riesennävi entwickelt haben [40, 48, 49]. Allerdings war die Ausgangssituation in den publizierten Fällen unterschiedlich (keines der Kinder hatte ein nävusassoziiertes Melanom, zusätzlich wurden einige ballonzellartige Nävuszell-Populationen beschrieben, die sich auch in den assoziierten Lymphknoten fanden) [40]. Außerdem wurden prophylaktische Lymphadenektomien und Extirpationen der Wächterlymphknoten durchgeführt [48, 49]; ein Jahr nach der Diagnose waren alle nodalen Einschlüsse noch vorhanden und den Kindern ging es gut. Die Fälle lassen sich also nur bedingt vergleichen, besonders da auch die immunhistochemischen Befunde nicht kongruent waren. Hara et al. berichteten über einen zweijährigen Jungen mit einem kongenitalen Riesennävus auf der rechten Seite des Bauchs, den Nates und den Beinen. Der Nävus wurde operativ entfernt, zusammen mit drei subkutanen Lymphknoten, die durch Zufall erfasst und untersucht wurden. Sie zeigten große perikapsuläre, kapsuläre und trabekuläre, perisinusoidale Nävus-Aggregate, die positiv für HMB45 waren [48]. Der Fall blieb also hinsichtlich der Dignität der Lymphknoteneinschlüsse weiterhin ungeklärt.
Der Einfluss nodaler melanozytärer Nävi auf das Überleben von Melanompatienten
Da es meistens Zufallsbefunde sind, müssen Dermatopathologen und allgemeine Pathologen bei ektopem Gewebe in Lymphknoten verschiedene Aspekte bedenken. Auch nach korrekter Interpretation solcher Gewebe-Einschlüsse im klinischen und onkologischen Kontext bleibt die Unsicherheit bezüglich benigner oder maligner Einordnung der nodalen Einschlüsse, was die weitere Behandlung der Patienten beeinträchtigen könnte (Über- oder Untertherapie). Hinzu kommt, dass Metastasen aufgrund anderer nodaler Einschlüsse übersehen werden könnten. Ein eindrucksvolles Beispiel sind Pigmente in Lymphknoten nach Tätowierungen. Wir konnten kürzlich belegen, dass Tätowierungspigmente in Lymphknoten das Überleben von Melanompatienten nicht beeinflussen [17]. Inzwischen gibt es mehrere Studien zum Einfluss von NMN auf das Überleben von Melanompatienten.
Gambichler et al. zeigten, dass NMN die Prognose von Melanompatienten nicht beeinflussen – die 5-Jahres-Überlebensrate dieser Patienten unterschied sich nicht von der bei Patienten ohne nodale Nävi [50]. Smith et al. kamen zum selben Ergebnis und zeigten, dass Patienten mit NMN so behandelt werden können wie Patienten mit negativen Wächterlymphknoten. Außerdem fand sich in dieser Studie ein signifikanter Überlebensvorteil für die Patienten mit NMN im Vergleich zu Patienten mit positiven Wächterlymphknoten oder einzelnen nodalen Tumorzellen [51]. De Beer et al. analysierten Daten aus der landesweiten niederländischen Datenbank für Histopathologie und Zytopathologie Dutch Nationwide Network and Registry of Histopathology and Cytopathology (PALGA) und stellten auch hier keinen Überlebensunterschied zwischen Patienten mit NMN und Patienten mit negativem Wächterlymphknoten fest [45].
Nodale blaue Nävi
Es gibt inzwischen zahlreiche Berichte zu nodalen blauen Nävi. Begum et al. publizierten den Fall einer Frau, mit einem blauen und einem gewöhnlichen benignen Nävus in einem Wächterlymphknoten. Die Patientin hatte ein invasives duktales Mammakarzinom, jedoch anamnestisch keinen Anhalt für ein kutanes Melanom. Zwei der vier exzidierten Wächterlymphknoten zeigten nodale blaue Nävi mit Ausbreitung in die fibröse Kapsel des Lymphknotens und die Trabekel [52]. Die Diagnose des blauen Nävus beruhte auf der geringen proliferativen Aktivität mit Ki67 und der benignen Zytomorphologie. HMB45 wurde sowohl von metastatischen als auch nodalen blauen Nävuszellen exprimiert [52]. Die meisten publizierten Fälle sind nicht leicht zu interpretieren, da sie blaue Nävuszellen mit HMB45-Expression in Wächterlymphknoten von Melanompatienten beschreiben. Die Interpretation als nodale blaue Nävi beruhte hier auf der Lokalisation der melanozytären Zellen in der Kapsel und den Trabekeln des Lymphknotens, dem Fehlen von Atypien und der Ähnlichkeit zu primären Tumorläsionen. Dies muss zumindest kritisch hinterfragt werden.
Der Einfluss der Interpretation nodaler melanozytärer Einschlüsse auf die Diagnose
Wächterlymphknoten werden Berichten zufolge in weniger als 5% aller Fälle falsch-negativ interpretiert. Dies liegt vermutlich mehrheitlich an Faktoren, die zeitlich vor der Untersuchung des Lymphknotens im Labor verortet werden: frühere operative Eingriffe mit Veränderung des Lymphabstroms, Unerfahrenheit des Operateurs, insuffiziente Detektionsmethoden [38]. Auch die Fehlinterpretation immunhistologischer Färbungen muss erwähnt werden, da auch bei der Immunfärbung Probleme auftreten können [38]. Unspezifische Antikörperfärbungen können ebenfalls zu Fehlern bei der Interpretation führen. Scognamiglio et al. heben die Bedeutung der sorgfältigen Interpretation von Wächterlymphknoten in der klinischen Onkologie hervor, was sie „Notwendigkeit der Vigilanz bei der pathologischen Bewertung der Wächterlymphknoten“ nennen [53].
Auch „falsch-positive“ Zellen in Wächterlymphknoten von Melanompatienten kommen vor. Der Begriff beschreibt, dass melanozytäre Zellen in Wächterlymphknoten von Patienten ohne bekanntes Melanom. Nicht alle melanozytären Zellen mit charakteristischer Linien-Differenzierung in der Imnunhistologie deuten also auf ein metastasiertes Melanom hin. So fanden sich Melan-A–positive Zellen in Wächterlymphknoten von Brustkrebs-Patientinnen ohne Melanom in der Anamnese [54]. Mögliche Erklärungen für solche „falsch-positiven“ Zellen sind nodale Nävuszellen, nicht-melanozytäre Zellen mit kreuzreagierenden Antigendeterminanten, Melanophagen, die melanozytäre Antigene präsentieren, oder auch Melanozyten beziehungsweise melanozytäre Stammzellen, die zum Zeitpunkt des operativen Eingriffs in der Haut freigesetzt wurden und sich über die drainierenden Lymphgefäße im Lymphknoten anreichern [54].
Vielversprechende Ansätze in der Differentialdiagnostik nodaler melanozytärer Nävi
Benigne Nävuszell-Einschlüsse und metastasierte Zellen eines malignen Melanoms in Lymphknoten können am besten zytomorphologisch unterschieden werden [37]. Es gibt aber auch viele Immunfärbungen zur Unterstützung der konventionellen Morphologie in Zweifelsfällen. Der immunhistochemische Nachweis von S100, Tyrosinase, SOX10 und Melan-A/MART-1 differenziert nicht zwischen nodalen Nävi und malignen Melanomen.
- – Intraparenchymale oder sinusoidale Proliferation melanozytärer Veränderungen, meist in Einzelzellformationen
- – Atypische zytomorphologische Kriterien (Mitosen, vakuolisierte Zellen)
- – Atypische Immunhistochemie (etwa HMB45-Positivität) ohne Möglichkeit zum Vergleich mit dem primären Melanom
Die genaue Kenntnis der Anfärbungsmuster für die verschiedenen Antikörper ist notwendig, um bei NMN diagnostische Probleme in der Untersuchung der Wächterlymphknoten-Biopsate von Melanompatienten zu vermeiden. Eines der größten sekundären Probleme bei der Diagnostik nodaler Nävi ist der Gewebeverlust während der technischen Verarbeitung: NMN sind meist klein und es sind etliche Immunfärbungen erforderlich (Abbildung 1e, f).
Tabelle 1 zählt wichtige Färbungen auf, die sich zur besseren Unterscheidung von Nävuszellen und Metastasen eignen, da sie in Nävuszellen und Melanom-Metastasen unterschiedlich ausfallen: Primäre und metastasierte Melanome zeigen eine diffuse zytoplasmatische Expression von PRAME, NMN hingegen exprimieren PRAME nicht [55]. Eine detaillierte Aufstellung spezifischer Expressionscharakteristika von PRAME in melanozytären Läsionen findet sich in der umfangreichen Arbeit von Cecilia Lezcano aus dem Jahr 2018 [56]. 87 % der untersuchten metastasierten Melanome und 83,2 % der primären Melanome exprimierten PRAME, jedoch waren 83,2 % der untersuchten Nävi PRAME-negativ [56]. Alle Formen des malignen Melanoms (noduläre, superfiziell spreitende und desmoplastische) exprimierten PRAME. Allerdings fanden Lezcano et al. auch bei 13,6 % der kutanen Nävi allen Typen (gewöhnliche erworbene, Spitz-, traumatisierte, und dysplastische Nävi) eine Immunreaktivität mit PRAME [56]. Raghavan et al. wiesen ebenfalls eine diffuse Expression von PRAME in benignen und atypischen Spitz-Nävi nach [57]. Diese Fehlerquellen sowie die Expression von PRAME in vielen anderen Tumoren solider Organe und in Sarkomen, schränken den Nutzen dieses Antikörpers für die Diagnostik maligner Tumoren erheblich ein – besonders wenn es um die Erkennung benigner melanozytärer Einschlüsse im Lymphknoten bei Patienten mit malignem Melanom geht.
| Antikörper | Expressionscharakteristika | Spezielle Bemerkungen zu nodalen Nävus-Nestern vs. metastasierten nodalen Melanomzellen | Einschränkende Bemerkungen | Literatur |
|---|---|---|---|---|
| PRAME (preferentially expressed antigen in melanoma) |
|
|
|
[87-92] |
| FASN (fatty acid synthase) ACC (Acetyl-CoA- Carboxylase) |
|
|
|
[93] [93-95] |
| 5-Hydroxymethylcytosin |
|
|
|
[96-98] |
| p16 |
|
|
|
[99, 100] |
Mib1 wird normalerweise in nodalen Nävi in deutlich geringerem Maße exprimiert als in Melanomen (in etwa 0–5 %), metastasierte Melanome sind jedoch konsistent positiv für Mib1 [39, 58]. Kanner et al. konnten bei der Reticulinfärbung deutliche Unterschiede zwischen individuellen nodalen melanoytären Zellen (nodalen Nävus-Einschlüssen) und den sie umgebenden gruppierten nodalen Metastasen eines Melanoms feststellen [59]. NM23, ein Metastasierungs-Suppressor-Gen, zeigte keine Unterschiede in der Anfärbung, die eine Differenzierung zwischen benignen und malignen Zellen erlauben [59].
HMB45 liefert bei NMN keine klaren Ergebnisse und ist nur eingeschränkt sinnvoll. Vierzig Prozent aller nodalen Melanom-Metastasen exprimierten HMB45 nicht [60]; daher kann ein negatives Ergebnis bei dieser Anfärbung ein Melanom nicht ausschließen [60, 61]. Umgekehrt beweist auch ein positives Anfärbungsergebnis mit HMB45 nicht Malignität, denn verschiedene benigne kutane Nävi und blaue Nävi exprimieren HMB45 [62]. Um nodale Nävi und Melanom-Metastasen klar zu unterscheiden, sind mehrere unterschiedliche Immunfärbungen nötig. Chen et al. wiesen nach, dass Nestin und Sox2 zur Unterscheidung zwischen nodalen Nävi und metastasierten Melanomen nützlich sind [63]. Nestin wird in Melanomen exprimiert, jedoch wesentlich weniger in nodalen Nävi. SOX2 wird in nodalen Nävi überhaupt nicht exprimiert, in Melanomen aber schon [63]. Innocenzi et al. berichteten im Jahr 2003 über die Expression von FASN (fatty acid synthase) in malignen Melanomen und Melanom-Metastasen (sowohl kutan als auch nodal). Sie schlugen FASN als zuverlässigen prognostischen Marker für humane Melanome vor [64]. Auch in dieser Arbeit war die Expression von FASN jedoch nicht spezifisch für Melanome oder Metastasierung [64]. Auch Kapur et al. berichteten, dass die Expression von FASN hoch spezifisch für Melanome und Melanom-Metastasen ist und dass FASN in Melanomen mit hohem Clark-Level stärker exprimiert wird. Jedoch konnten sie auch in benignen kutanen Nävi eine FASN-Expression beobachten [65]. In der Arbeit von Saab et al. waren FASN und ACC (Acetyl-CoA-Carboxylase) konsistent positiv in metastasierten Melanomen und negativ in nodalen Nävi [60]. In dieser Arbeit waren alle NMN negativ für FASN und ACC, mit einer Sensitivität und Spezifität von 100 %. Bei HMB45 dagegen betrug die Sensitivität 60 % und die Spezifität 100 % bei der Identifizierung von Melanom-Metastasen und der Unterscheidung von NMN [60]. Lee et al. führten die Expression von 5-Hydroxymethylcytosin als zusätzlichen Marker zur Differenzierung ein, da es in allen untersuchten nodalen Nävi zur Anfärbung führte und in allen Melanomen negativ war [66]. Auch p16 kann hilfreich für die Differenzierung sein, da es hauptsächlich in allen Arten von Nävi exprimiert wird (kutanen und nodalen), während Zellen aus Melanom-Metastasen keine nukleäre Anfärbung auf p16 zeigten [67, 68]. Mihic-Probst et al. untersuchten das Färbemuster für p16 in nodalen und dermalen melanozytären Nävi und in Melanom-Metastasen. Aufgrund dieses Musters halten sie p16 für einen nützlichen zusätzlichen Marker in der Differenzierung zwischen Nävi und Melanom-Metastasen [67]. Unsere eigene Meinung jedoch ist: Das Färbemuster ist schwierig zu bewerten (nukleär versus zytoplasmatisch versus schwach nukleär und diffus zytoplasmatisch) und nicht eindeutig. Daher sollte p16 niemals als einziger Parameter verwendet werden, sondern nur als Teil eines Spektrums verschiedener Antikörper.
Zusammengefasst werden p16 und 5-Hydroxymethylcytosin in nodalen Nävuszellen, nicht aber in metastasierten Melanomen exprimiert. Umgekehrt findet sich FASN, ACC, Mib1, PRAME, Nestin und SOX2 überwiegend in Melanomen und nicht in nodalen Nävi.
Für die tägliche Histopathologie verwenden und empfehlen wir die regelmäßige Anwendung eines Antikörper-Panels bestehend aus einem Antikörper-Cocktail (Dako DuoFLEX Cocktail, anti-S100, anti-Tyrosinase, anti-Melan A; Code IC001) und HMB45 zur Routinefärbung von Lymphknoten bei bekanntem kutanem Melanom. Damit können auch primäre melanozytäre Ablagerungen sichtbar gemacht werden, die in der Hämatoxylin-Eosin-Färbung am häufigsten zu sehen sind. Die unterschiedliche Expression von HMB45 erleichtert die primäre Differenzierung von metastatischen Ablagerungen. Weitere immunhistochemische Anfärbungen erfolgen auf individueller Basis. Mit diesem Ansatz gelingt die Charakterisierung der meisten nodalen Einschlüsse.
Zur Unterstützung der konventionellen und immunhistochemischen Untersuchungen bei der Unterscheidung zwischen metastasiertem Melanom und nodalem Nävus scheint die Fluoreszenz-in-situ-Hybridisierung (FISH) ideal geeignet. Zwar kann die FISH-Untersuchung die histomorphologische Beurteilung nicht ersetzen, mit einer Sensitivität von 83 % stellt sie aber eine nützliche Ergänzung dar [69]. Dalton et al. konnten bestätigen, dass eine ausgeprägte Expression von HMB45 tatsächlich hoch spezifisch für ein Melanom oder metastasierte nodale Einschlüsse desselben Primärtyps ist. Die Interpretation dieser Befunde lässt sich noch signifikant verbessern, wenn bei der Suche nach Mutationen nicht nur die nodalen melanozytären Einschlüsse, sondern auch das primäre Melanom untersucht werden kann. Fälle, in denen die nodalen Ablagerungen keine genetischen Veränderungen aufweisen, die mit dem primären Melanom übereinstimmen, können als NMN betrachtet werden [69].
Theorien zur Histogenese nodaler Einschlüsse
Derzeit werden verschiedene Theorien zur Genese ektoper Gewebe in Lymphknoten diskutiert, jedoch ist letztlich keine davon zufriedenstellend, insbesondere was die nodalen melanozytären Einschlüsse angeht. Für die Endosalpingiose umfasst die Diskussion die folgenden Möglichkeiten der Genese: Verschleppung nach Operationen [70], peritoneale Implantation abgelösten Tubenepithels [70], lymphatische Dissemination von Tubenmukosa [23], Metaplasie von peritonealem Mesothel und Submesothel aus dem Müller-Gang im Becken mit anschließender Bildung benigner Drüsen (Endosalpingiose) oder Karzinomen mit Ähnlichkeiten zu denen des Ovars und der Tube [8]. Der Einschluss von Geweberesten während der Embryonalentwicklung sowie Müllergang-artige embryonale Reste des Coelom-Epithels sind weitere mögliche Erklärungen zur Pathogenese [2].
Pathophysiologe von Nävus-Aggregaten in Lymphknoten
- – Theorie der benignen Metastasierung: embolische Übertragung kutaner melanozytärer Zellen über den Lymphweg von der Haut in den drainierenden Lymphknoten [9, 72].
- – Theorie der gehemmten Migration: Nodale Nävozyten entstehen aus melanozytären Vorläuferzellen, deren embryonale Migration von der Neuralleiste zu ihrem Ziel in der Haut entlang dem dorsolateralen Migrationsweg gehemmt wurde [10, 72, 73].
Wir gehen davon aus, dass es mehr als eine richtige Antwort und mehr als eine Erklärung für nodale Nävuszell-Einschlüsse gibt. Aus unserer Sicht gibt es jeweils nur wenige überzeugende Argumente für oder gegen die eine oder die andere Theorie. So erklärt die Theorie der gehemmten Migration nicht, warum nodale Nävi in den Wächterlymphknoten von Patienten mit Melanomen häufiger sind als in denen von Patienten mit anderen Tumoren.
Ganz allgemein erklärt sich die Ursache für jegliche Art von Einschlüssen in Lymphknoten dadurch, dass alle Arten von Zellen über Lymphgefäße zu drainierenden Lymphknoten transportiert werden können; es kommt nur im Falle von Dickdarmdrüsen, Nierenepithel, Urothel, einigen melanozytären Nävi und Endometriose häufiger vor [25]. Das gelegentliche Auftreten extrinsischen Gewebes in Lymphknoten ist gut dokumentiert. Sogar azelluläres bis paucizelluläres Material aus solaren Elastosen ist in Lymphknoten zu finden [15]. In vielen Fällen ektoper oder heterotoper Gewebe-Einschlüsse in Lymphknoten könnten ein passiver mechanischer Transport oder ein Trauma eine bedeutende Rolle spielen.
Bezüglich nodaler Einschlüsse von Brustdrüsengewebe werden zwei Optionen diskutiert: Die Ausbreitung von Tumorzellen nach Operation durch mechanischen Transport über das Lymphsystem mit anschließender Anreicherung in den Lymphknoten, oder Massage der Brust bei der Biopsie der Wächterlymphknoten [74]. Auch bei Aggregaten melanozytärer Zellen in Lymphknoten wurde eine Trauma-assoziierte Genese aufgrund vorausgegangerer Operation zur Entfernung des primären Melanoms diskutiert.
Diese ziemlich mechanistische Theorie erscheint zunächst logisch, hat aber erhebliche Schwächen. Reicht die Zeit zwischen der chirurgischen Entfernung eines primären Melanoms und der anschließenden Biopsie der Wächterlymphknoten dafür aus, dass mechanisch abgelöste melanozytäre Zellen aus der Haut über das Lymphsystem in den Lymphknoten gelangen, sich dort festsetzen und ein nodales Nävus-Aggregat bilden? Das erscheint wenig wahrscheinlich. Mit dieser Theorie ließen sich nur einzelne versprengte Tumorzellen in den Wächterlymphknoten erklären. Allerdings wäre dies dann genau das Gegenteil eines benignen Prozesses (keine „benignen Metastasen“). Stattdessen würde es sich – nach paradigmatischer Definition – um den Beginn der lymphatischen Ausbreitung der malignen Tumorzellen in die korrespondierenden Lymphknoten handeln.
Dass benigne Nävomelanozyten durch die Lymphgefäße gespült werden, ist gut bekannt. Sood et al. berichteten über den Fall eines kleinen Jungen mit intradermalem melanozytärem Nävus und intralymphatischen Nävuszell-Emboli. Anhand dieses Falles diskutierten sie das Konzept der Nävusentstehung durch benigne Metastasierung [75]. Schon 1979 publizierten Bell et al. eine Fallserie mit dermalen Nävuszell-Nävi mit intralymphatischen Nävuszell-Nestern [76]. Bei gewöhnlichen dermalen Nävi wurde dieses Konzept eher selten beobachtet und publiziert, bei Spitz-Nävi jedoch deutlich öfter. Howat et al. berichteten über eine Häufigkeit von 14,3 % [77]. Nach der Theorie der benignen Metastasierung und angesichts der häufigen Beobachtung lymphatischer Nävuszell-Emboli bei Spitz-Nävi würde man in Wächterlymphknoten oder im Fall von Lymphknotenexstirpationen bei Patienten mit kutanen spitzoiden Läsionen vermehrt nodale Einschlüsse von melanozytären Zellen erwarten. Überraschenderweise ist dies jedoch nicht der Fall. Ganz im Gegenteil: Caraco et al. untersuchten retrospektiv 40 Fälle atypischer Spitz-Nävi. In keinem einzigen dieser Fälle fanden sich melanozytäre Einschlüsse in den Lymphknoten, weder als benigne nodale Spitz-Nävi noch als metastatische Absiedlung [78]. Die Theorie der benignen Metastasierung wird gestützt durch den Befund, dass benigne Nävuszellen im Blut zirkulieren können – die Disseminierung von Nävuszellen kann also sowohl lymphatisch als auch über den Blutstrom erfolgen [79]. Leblebici et al. unterstützen die mechanische Theorie der benignen Metastasierung in Lymphknoten; sie konnten intralymphatische Nävuszell-Aggregate bei 13 von 369 benignen kutanen Nävi (3,5 %) nachweisen. Alle untersuchten Nävi zeigten eine Protrusion von Nävuszellen in die Lymphgefäße, unabhängig davon, ob intralymphatische Nävuszell-Aggregate nachzuweisen waren [80]. Protrusionen von Nävuszellen in den Lymphgefäßen könnten eine Vorstufe intralymphatischer Nävuszell-Aggregate sein, denn diese Befunde hängen stark von den untersuchten Gewebesektionen ab. Allerdings dürfte es länger als nur ein paar Tage oder Wochen dauern, bis sich einzelnen Nävuszellen in einem Lymphknoten ansiedeln.
Paradigmenwechsel?
Was die Materie noch komplizierter macht ist, dass die Theorie der benignen Metastasierung einem der grundlegenden pathologischen Paradigmen widerspricht, nämlich dass die Aussaat von Gewebe über den Lymphweg in die Lymphknoten ein definierendes Kriterium für Malignität ist. Die Theorie einer benignen und klinisch irrelevanten Metastasierung, aufgestellt von Pulitzer et al. vor dem Hintergrund der Aussaat elastotischen Materials in Lymphknoten [15], ist aus einem mechanistischen Blickwinkel plausibel, erfordert aber einen Paradigmenwechsel in der klinisch-pathologischen Onkologie.
Räumliche und zeitliche Aspekte sprechen allerdings gegen die Theorie einer benignen Metastasierung in Fällen, wo nodale Nävi ohne kutane Nävi in den korrespondierenden Hautarealen auftreten. Ebenso sprechen sie im Kontext der Wächterlymphknoten-Biopsie gegen die Absiedlung mechanisch oder traumatisch mobilisierter kutaner Nävuszellen in Lymphknoten. Das Konzept der benignen Metastasierung könnte die beste Erklärung für nicht-melanozytäre ektope Gewebe und auch für das gelegentliche Auftreten nodaler Nävi bei Patienten ohne Melanome liefern – aber nicht für NMN im Kontext einer Biopsie der Wächterlymphknoten bei malignem Melanom.
Es könnte eine ganz einfache Erklärung geben: Melanompatienten haben durchschnittlich mehr als doppelt so viele melanozytäre Nävi wie Kontrollpersonen gleichen Alters und Geschlechts [81]. Man kann also diskutieren, ob das vermehrte Vorkommen melanozytärer Nävi im Zusammenhang mit Melanomen dann auch zu einer erhöhten Wahrscheinlichkeit des Transports melanozytärer Zellen in die Lymphknoten führt.
Melanome können auch primär extrakutan auftreten, etwa an der Mukosa im Kopf- und Halsbereich, an den Genitalien, in den Harnwegen, im Ösophagus oder den Gallengängen, aber auch als meningeale oder choroidale Melanome [82]. Hier stellt sich die Frage, warum NMN nicht auch in den tieferen viszeralen Lymphknotenstationen vorkommen. Das häufigere Auftreten nodaler Nävi in den oberflächlichen Lymphknoten von Patienten mit malignen kutanen Melanomen wird historisch mit dem Konzept der benignen Metastasierung oder der Migrationshemmung erklärt. Trifft dies zu, dann sollten nodale Nävi auch in den Lymphknoten des tiefen viszeralen Kompartments auftreten können – das wurde aber bisher noch nie berichtet.
Falls melanoblastische Zellen in der Lage sind, durch den omphalomesenterischen Kanal [82] auch in den Dünndarm (Ileum) zu migrieren, und diese die Ursprungszellen für primäre Melanome des Gastrointestinaltrakts sind [83], dürfte man erwarten, dass wesentlich mehr Fälle von nodalen Nävi in viszeralen Lymphknoten hätten publiziert werden müssen. Ektope Melanozyten sind eine mögliche Erklärung für die Entwicklung von Melanomen mit unbekanntem Ursprungsort [83, 84]. Man könnte allerdings auch an die Differenzierung von Melanozyten aus vorbestehenden pluripotenten Stammzellen bestimmter Standorte denken (etwa Lymphknoten, viszerale Organe).
Der „schlafende ektope Melanoblast“
Wir schlagen hier ein anderes, eher außergewöhnliches aber vereinheitlichendes Konzept der Nävogenese in Lymphknoten bei Melanompatienten vor. Wir möchten es „die Theorie des schlafenden ektopen Melanoblasten“ nennen. Die hypothetische Koexistenz primärer ektoper Melanozyten – durch Hemmung der Migration – und ektoper pluripotenter Stammzellen in allen oben genannten Kompartimenten (in denen extrakutane Melanome auftreten können) würde alle klinischen und histomorphologischen Aspekte nodaler Nävi erklären, besonders das häufigere Auftreten in den Wächterlymphknoten. Das Konzept des Lymphknotens als einer prämetastatischen Nische stützt unsere Theorie [85]. Unter bestimmten Umständen könnte es bei Melanompatienten zu einer Art unbemerkter Induktion der Expression von prometastatischen Wachstumsfaktoren und Zytokinen kommen, zusammen mit Faktoren, die einen Umbau (Remodeling) der extrazellulären Matrix innerhalb der Lymphknoten induzieren. Diese Bedingungen könnten Signalwege begünstigen, die zu einer veränderten Plastizität der Melanoblasten und einzelnen ektopen Zellen führen, die sich seit der frühen Entwicklung in den Lymphknoten angesiedet haben. Daraus könnte dann eine Proliferation und Differenzierung zu einem nodalen Nävus resultieren, oder auch – über den lymphatischen Transport von Tumorzellen hinaus – zu einer malignen Transformation der residenten melanoblastischen Zellen.
Auf Basis der allgemein akzeptierten Tatsache, dass es sich bei den Vorläuferzellen von Melanoblasten und der neurogenen Population um bipotente glial-melanozytäre Progenitorzellen mit der Fähigkeit zur Differenzierung in unterschiedliche Zelllinien handelt [86], ist es unserer Meinung nach vorstellbar, dass diese nodalen ektopen und/oder pluripotenten melanozytären Vorläuferzellen differenziert aktiviert werden können. Dies könnte entweder über bestimmte Treibermutationen erfolgen, die charakteristisch für kutane Melanome sind, oder über Faktoren, die durch das primäre kutane Melanom freigesetzt werden. Die Folge wäre eine anschließende Differenzierung zu nodalen nävoiden Aggregaten in allen nodalen Kompartimenten unabhängig von afferenten Lymphgefäßen.
Danksagung
Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikte
Cornelia S.L. Müller: Beratertätigkeit für UCB Pharma; Reisekostenzuschüsse von Pierre Fabre, Janssen Cilag. Claudia Pföhler: Beratertätigkeit, Vortragshonorare, Reisekostenzuschüsse: BMS, MSD, Merck Serono, Roche, Amgen, GSK, Novartis, Sanofi Genzyme, Pierre Fabre, LEO; klinische Studien: Novartis, BMS. Stephan G. Müller und Thomas Vogt erklären, dass keine Interessenkonflikte im Zusammenhang mit der Publikation dieses Artikels bestehen.