Hochdosierte intravenöse Immunglobuline bei dermatologischen Autoimmunerkrankungen
Redaktion
Prof. Dr. D. Nashan, Dortmund
Hochdosierte intravenöse Immunglobuline (IVIg) werden aufgrund ihrer immunmodulatorischen Eigenschaften erfolgreich zur Behandlung dermatologischer Autoimmunkrankheiten eingesetzt.
Immunglobuline, die zu 75 % der Klasse IgG angehören, bilden mit den zugehörigen Antigenen, u. a. in Abhängigkeit von den Einzelkonzentrationen, lösliche oder unlösliche Immunkomplexe.
Durch moderne Herstellungs- und Screeningverfahren, die strengen Regularien unterliegen, wird die Produktion von IVIg mit einer Reinheit von mehr als 95 % IgG bei sehr geringer Gefahr einer viralen Transmission ermöglicht.
Die Wirkweise von IVIg ist im Einzelnen unklar. Nicht konkurrierende Hypothesen postulieren eine Hochregulation inhibitorischer Fc-Rezeptoren, eine reduzierte Halbwertszeit von Autoantikörpern durch Verdrängung aus protektiven Rezeptorbindungen, die direkte Neutralisierung körpereigener Antikörper durch antiidiotypische Antikörper sowie die Inhibierung der Komplementkaskade.
Auf der zellulären Ebene stehen Effekte auf dendritische Zellen, T-Zellen, B-Zellen und Makrophagen im wissenschaftlichen Fokus.
Die Behandlung mit IVIg wird überwiegend sehr gut vertragen. Häufigere Nebenwirkungen stellen Kopfschmerzen, Übelkeit, Fatigue und eine febrile Infusionsreaktion dar, die in den meisten Fällen mittels symptomatischer Gegenmaßnahmen abgefangen werden können. Sehr selten kommt es zum auftreten schwerer Nebenwirkungen wie thromboembolischer Ereignisse, anaphylaktischem Schock oder akutem Nierenversagen.
Erfahrungen mit der Anwendung von IVIg bestehen in der Dermatologie seit über zwei Jahrzehnten.
IVIg werden bei dermatologischen Indikationen in der Regel in einer Dosierung von 2 g/kg KG über 2–5 Tage alle vier Wochen infundiert.
Zur Minimierung von Nebenwirkungen sollte auf eine ausreichende Hydrierung vor, während und nach den IVIg-Infusionen geachtet werden.
Die Relevanz spezifischer Autoantikörper ist für die Entstehung bullöser Autoimmundermatosen in einem besonders hohen Maß wissenschaftlich belegt.
Die Relevanz spezifischer Autoantikörper ist für die Entstehung bullöser Autoimmundermatosen in einem besonders hohen Maß wissenschaftlich belegt.
Bei bullösen Autoimmundermatosen kann der adjuvante Einsatz von IVIg als Zweit- oder Drittlinientherapie nach Versagen einer kombinierten immunsuppressiven Therapie erfolgen.
Als ein zentrales pathogenetisches Element der Dermatomyositis wird klassischerweise eine antikörper- und komplementmediierte Mikroangiopathie angesehen.
IVIg können in der Behandlung der klassischen adulten Dermatomyositis als adjuvante Zweitlinientherapie bereits nach Versagen einer Steroidmonotherapie erwogen werden.
Das Skleromyxödem ist eine chronisch-progrediente Ablagerungsdermatose, die häufig in Assoziation mit einer monoklonalen Gammopathie auftritt.
Aufgrund mangelnder Therapiealternativen können IVIg bei schweren Verläufen des Skleromyxödems als Erstlinientherapie eingesetzt werden.
Vaskulitiden werden nach der Chapel-Hill-Konsensus-Konferenz ganz wesentlich entsprechend der Größe der betroffenen Gefäße klassifiziert und können unter anderem in Assoziation mit antineutrophilen zytoplasmatischen Antikörpern oder prominenten Immunkomplexablagerungen auftreten.
In therapierefraktären Fällen schwerer systemischer Vaskulitiden kann die Anwendung von IVIg erwogen werden. Bei dem, meist pädiatrisch betreuten Kawasaki-Syndrom stellt die Gabe von IVIg eine First-Line-Maßnahme dar.
Der systemische Lupus erythematodes ist eine Multisystemerkrankung mit, möglicherweise UV-induzierter, pathogenetisch bedeutsamer Produktion antinukleärer Antikörper.
IVIg können in schweren Fällen zur Behandlung des systemischen Lupus erythematodes eingesetzt werden. Eine belastbare Indikation zum Einsatz bei rein kutanen Fällen besteht abgesehen von Ausnahmefällen nicht.
Zusammenfassung
Hochdosierte intravenöse Immunglobuline (IVIg) werden aufgrund ihrer immunmodulatorischen Eigenschaften erfolgreich zur Behandlung dermatologischer Autoimmunkrankheiten eingesetzt. Hierbei stellen der Pemphigus vulgaris und die Dermatomyositis klassische Indikationen dar. Bei den bullösen Autoimmundermatosen kann der adjuvante Einsatz von IVIg als Zweit- oder Drittlinientherapie nach Versagen einer kombinierten immunsuppressiven Therapie erfolgen, während in der Behandlung der Dermatomyositis IVIg bereits als adjuvante Zweitlinientherapie nach Versagen einer Steroidmonotherapie eingesetzt werden können. Aufgrund mangelnder Therapiealternativen können IVIg bei schweren Verläufen des Skleromyxödems als Erstlinientherapie eingesetzt werden. In therapierefraktären Fällen einer schweren systemischen Vaskulitis kann die Anwendung von IVIg erwogen werden. Ebenso stellen schwere Fälle eines systemischen Lupus erythematodes eine mögliche Indikation zum Einsatz von IVIg dar. Auch zur Behandlung der toxischen epidermalen Nekrolyse können IVIg bei frühzeitigem und hochdosiertem Einsatz indiziert sein. Häufigere, gut zu behandelnde Nebenwirkungen stellen Kopfschmerzen, Übelkeit, Fatigue und eine febrile Infusionsreaktion dar. Sehr selten kommt es zum Auftreten schwerer Nebenwirkungen wie thromboembolischen Ereignissen, anaphylaktischem Schock oder akutem Nierenversagen. Das Risiko einer viralen Transmission ist sehr gering. Hypothesen zur Wirkweise sind die Hochregulation inhibitorischer Fc-Rezeptoren, eine reduzierte Halbwertszeit von körpereigenen Immunglobulinen durch Verdrängung aus protektiven Rezeptorbindungen, die direkte Neutralisierung körpereigener Antikörper durch antiidiotypische Antikörper, sowie die Inhibierung der Komplementkaskade.
Einleitung
Polyklonale Immunglobuline, die üblicherweise aus dem Plasma zahlreicher humaner Spender gewonnen werden, kommen neben der klassischen Substitution bei humoraler Immundefizienz inzwischen bereits seit mehr als drei Jahrzehnten auch als Immunmodulatoren in der Therapie von Autoimmunkrankheiten erfolgreich zum Einsatz. Während es sich bei erster Indikation überwiegend um pädiatrische Krankheitsbilder handelt, fallen in die zweite Behandlungskategorie neben neurologischen und hämatoonkologischen zahlreiche dermatologische Erkrankungen. Der dermatologische Einsatz erfolgt in der Regel als intravenöse Immunglobulin G (IVIg)-Therapie in deutlich höherer Dosierung als für die Substitution bei Immundefizienz erforderlich. Die subkutane Applikation (subcutaneous immunoglobulin G, SCIg) stellt eine Alternative bei der Substitutionsbehandlung und einzelnen neurologischen Autoimmunkrankheiten dar, hat in der dermatologischen Indikation aber noch keinen Stellenwert.
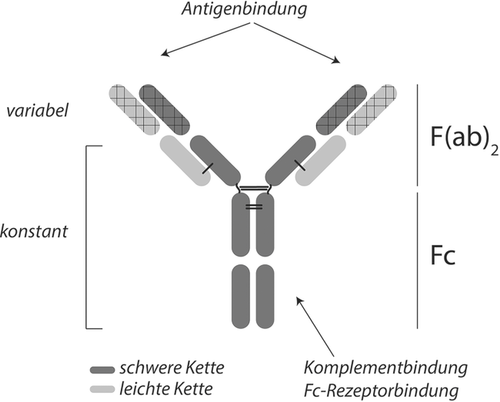
Immunglobuline, auch als Antikörper bezeichnet, sind wesentliche Bestandteile des erworbenen Immunsystems, werden nach Stimulation durch Fremd- oder Autoantigene von Plasmazellen produziert und liegen im normalen Serum in einer Konzentration von 7–12 g/l vor. Hierbei gehören 75 % der Immunglobuline der Klasse IgG an, während sich 25 % auf die Klassen IgA, IgM, IgD und IgE verteilen. Es handelt sich um Glykoproteine, die aus zwei identischen leichten sowie zwei identischen schweren durch Schwefelbrücken verbundenen Ketten bestehen (Abbildung 1). Die aminoterminalen Abschnitte der leichten und schweren Ketten (2 Fab-Fragmente pro Immunglobulin, die gemeinsam als F(ab)2-Fragment angesprochen werden) sind hierbei hochvariabel und stellen die antigenbindende Domäne dar, während das Fc-Fragment von konstanten Teilen der schweren Kette gebildet wird und unter anderem der Komplementaktivierung und Rezeptorbindung bzw. Opsonisierung dient. Die funktionellen Eigenschaften von Immunglobulinen werden nicht unwesentlich durch den Besatz mit Zuckerresten, der Glykosylierung, beeinflusst 1. Verbindungen aus mindestens einem Antikörper und zugehörigem Antigen werden als Immunkomplexe bezeichnet. Während kleinere Immunkomplexe aus Antikörpern mit löslichen Antigenen üblicherweise ebenfalls löslich sind und durch das retikuloendotheliale System abgebaut werden können, neigen größere Aggregate zur Präzipitation.
Herstellung
Die Herstellung von IVIg folgt in Europa Regularien der Europäischen Pharmakopoeia (EDQM). Üblicherweise wird das Plasma von mindestens 1000, meist mehr als 10 000 Spendern für die Herstellung einer Charge polyklonaler Immunglobuline verwendet, welche somit den Antikörperpool der jeweiligen Population annähernd reflektiert. Hierbei ist die große Menge an Spendern nicht zuletzt deshalb wichtig, um mit jeder Charge ein zumindest vergleichbares Produkt zu erhalten. Das Plasma kann aus Vollblutspenden oder mittels Plasmapherese gewonnen werden. Am Anfang der Plasmaaufbereitung steht in der Regel die Reinigung mittels Kryopräzipitation. Dank moderner Mehrschrittverfahren können aus einem Liter Plasma bis zu 4,5 g IgG gewonnen werden, wobei das Endprodukt eine Reinheit von mehr als 95 % aufweist. Hierbei liegt, aufgrund des seltenen Auftretens von Anaphylaxien, ein besonderes Augenmerk auf einem möglichst geringen IgA-Gehalt 2. Bereits durch die Aufbereitung erfolgt eine Inaktivierung von Viren. Weitere Schritte, die unternommen werden, um eine Übertragung von Krankheitserregern zu verhindern, umfassen das epidemiologische Screening der Spender sowie virologische Untersuchungen am Spenderblut und dem gepoolten Plasma. Bislang sind keine Berichte über durch IVIg übertragene Hepatitis B, HIV oder Prionen-Erkrankungen bekannt. Übertragungen von Hepatitis C wurden bis 1995 sporadisch berichtet. Die Tatsache, dass seitdem keine neuen Erkrankungsfälle bekannt wurden ist unter anderem auf verbesserte Aufbereitungs- und Screeningmaßnahmen zurückzuführen. Neben Immunglobulinen können aus einer Charge Plasma auch Fibrinogen und Faktor IX gewonnen werden. Zu den Begleitsubstanzen, die im Verdacht stehen an der Entwicklung von Nebenwirkungen beteiligt zu sein, gehören neben verschiedenen Zuckern, auf deren Bedeutung in der Rubrik klinische Anwendung näher eingegangen wird, Glycin, Natrium-Chlorid und Albumin. Kommerzielle Immunglobulinformulationen zur intravenösen Anwendung werden in der Regel als hochkonzentrierte, leicht saure Lösungen (50 g/l bis 100 g/l) vertrieben. Hierbei können sich die Eigenschaften verschiedener kommerzieller Produkte unterscheiden 3. Ob sich hierdurch Unterschiede in der klinischen Effektivität ergeben bleibt spekulativ.
Wirkweise
Seit der Erstbeschreibung der immunmodulatorischen Kapazität von IVIg wurden zahlreiche Wirkmechanismen postuliert, die überwiegend synergistisch denkbar sind. Hierbei können Wirkungen des Fc- und F(ab)2-Fragments sowie Effekte auf der zellulären Ebene unterschieden werden (Tabelle 1).
Tabelle 1. Hypothesen zur immunmodulatorischen Wirkung von IVIg.
F(ab)2 Fragment
|
Fc-Fragment
|
Zelluläre Ebene
|
IgG-bindende Fc-Rezeptoren finden sich auf einer Vielzahl humaner Zellen (u. a. Leukozyten, Thrombozyten, Endothel- und Epithelzellen), werden als Fcγ-Rezeptoren angesprochen und alphanumerisch in weitere Subgruppen aufgeteilt. Die Aktivierung erfolgt durch monomere Immunglobuline oder, meist deutlich effektiver, durch Immunkomplexe. Eine führende Hypothese besagt, dass die immunmodulatorische Wirkung von IVIg auf einer Hochregulation von inhibitorischen Fcγ-Rezeptor-IIb (FcγRIIB)-Rezeptoren beruht. In der Tat profitierten FcγRIIB-Knockout-Mäuse in Mausmodellen der idiopathischen immunthrombozytopenischen Purpura (ITP) und Arthritis nicht von einer Behandlung mit IVIg 4, 5. Ferner wurde gezeigt, dass bei der chronisch entzündlichen demyelinisierenden Polyneuropathie, einer auf Behandlung mit IVIg gut ansprechenden Krankheit, die Oberflächenexpression von FcγRIIB auf B-Zellen pathologisch reduziert ist 6. Unklar ist bislang, wie IVIg FcγRIIB hochreguliert. Eine überzeugende Hypothese von Kaneko, Nimmerjahn und Ravetch 7 besagt, dass hierfür eine antiinflammatorische Sialylierung, ein bestimmter Oberflächenbesatz mit Aminozuckern, des Fc-Anteils der IVIg verantwortlich sei. Hierbei kommt DC-SIGN, einem Rezeptor, dessen Funktion bislang vornehmlich in der Erkennung von pathogentypischen Oberflächenzuckermustern gesehen wurde, möglicherweise eine Rolle als sialylierungsabhängiger Fcγ-Rezeptor zu 8. In einem Arthritis-Mausmodell führten IVIg in Abhängigkeit von DC-SIGN zu einer vermehrten Produktion der Th2-assoziierten Zytokine IL33 und IL4 mit konsekutiver Hochregulation von FcγRIIB auf Makrophagen 9. Es ist jedoch erwähnenswert, dass die Wirkung von IVIg bei der ITP unabhängig von IL4 und IL33 zu sein scheint und der oben genannte Signalweg somit keine globale Erklärung für die Effekte von IVIg liefert 8. Der neonatale FcRn-Rezeptor, der nach Pinozytose (Aufnahme von kleinen Mengen von Flüssigkeit und gelösten Substanzen aus der Zellumgebung) durch endosomale Zirkulation und letztlich erneute Ausschleusung die Halbwertszeit von Immunglobulinen erhöht, bindet ebenfalls den Fc-Anteil von IgG mit niedriger Affinität. Es konnte diesbezüglich gezeigt werden, dass IVIg andere Immunglobuline des Empfängers (Autoantikörper etc.) aus der FcRn-Bindung verdrängen und hierdurch deren Halbwertszeit reduzieren können 10. Rasche Effekte binnen weniger Stunden, wie sie auf die Depletion von Thrombozyten im Mausmodell der ITP beobachtet werden 11, erscheinen durch einen ausschließlich FcRn-abhängigen Mechanismus allerdings unzureichend erklärt. Abschließend soll aufgeführt werden, dass durch Bindungsstellen auf dem Fc-Anteil Komplementfaktoren, im Besonderen C3b, das an der Initiierung der Komplementkaskade beteiligt ist, abgefangen und möglicherweise über das retikuloendotheliale System abgebaut werden 12.
Auch für das F(ab)2-Fragment wurden therapeutische Effekte postuliert. So treten in einem gesunden IgG-Pool antiidiotypische Antikörper auf, die andere Antikörper, unter anderem Autoantikörper, direkt binden und inaktivieren können 13. Ferner konnte gezeigt werden, dass Komplementfaktoren wie C3a und C5a, die als sogenannte Anaphylatoxine eine wichtige proinflammatorische Funktion haben, von F(ab)2-Fragmenten gebunden und neutralisiert werden 14, 15. Für die Wirkweise bei der Mehrzahl der humanen Autoimmunerkrankungen scheinen diese Effekte jedoch von untergeordneter Bedeutung, da auch Fc-Fragmente von IVIg allein eine Wirkung bei der ITP sowie Mausmodellen der Arthritis und Nephritis zeigen 16-18.
Auf der zellulären Ebene stehen dendritische Zellen, T-Zellen, B-Zellen und Makrophagen im wissenschaftlichen Fokus. Es konnte gezeigt werden, dass IVIg in partieller Abhängigkeit von DC-SIGN durch Modulation des Zytokinmusters dendritischer Zellen regulatorische T-Zellen, die eine wichtige entzündungshemmende Funktion einnehmen und im gesunden Organismus an der Erhaltung der Selbsttoleranz beteiligt sind, expandieren 19-21. Im Gegensatz hierzu wird die Reifung und Funktion von proinflammatorischen Th17-Zellen, die physiologisch in Interaktion mit neutrophilen Granulozyten unter anderem Pilzinfektionen abwehren, aber auch an der Chronifizierung von Entzündungsreaktionen beteiligt sind, durch IVIg inhibiert. Ein Effekt, der interessanterweise F(ab)2 vermittelt zu sein scheint 22. Die Aktivierung einer B-Zelle erfordert die Bindung eines geeigneten Antigens an den B-Zell-Rezeptor in Anwesenheit kostimulatorischer Signale. Es konnte diesbezüglich gezeigt werden, dass IVIg in Abhängigkeit von ihrer Sialylierung zu einer reduzierten Aktivierbarkeit von B-Zellen, unter anderem durch verminderte Expression kostimulatorischer Differenzierungsmarker, führen 23, 24. Abschließend konnte durch intravitale Mikroskopie gezeigt werden, dass IVIg die Adhäsion von Leukozyten an Gefäßendothelien hemmen 25. Die Effekte auf Makrophagen wie beispielweise ein verändertes Fc-Rezeptor-Repertoire wurden bereits in den vorigen Absätzen kurz thematisiert.
Neben den immunmodulatorischen Effekten wird durch Gabe von IVIg ein polyvalenter Antikörperpool verabreicht, der hypothetisch bei anderweitig immunsupprimierten Patienten eine infektprophylaktische Wirkung entfalten kann.
Nebenwirkungen
Die Behandlung mit IVIg wird in der Regel sehr gut vertragen. Häufige Nebenwirkungen sind Kopfschmerzen, Übelkeit, Fatigue sowie eine febrile Infusionsreaktion. Sofern die Beschwerden kein Anzeichen für eine schwerwiegende, zugrundeliegende Nebenwirkung oder Begleiterkrankung darstellen, ist in vielen Fällen eine symptomatische Behandlung ausreichend, die je nach Symptom analgetische, antiphlogistische, antihistaminerge und antiemetische Maßnahmen sowie die Reduktion der Infusionsgeschwindigkeit und eine begleitende i.v.-Flüssigkeitssubstitution umfassen kann. Schwerwiegende, seltene Nebenwirkungen stellen thromboembolische Ereignisse inklusive kardiovaskulärer Ereignisse, vermutlich aufgrund einer gestörten Rheologie, Hypervolämie mit Lungenödemen, akutes Nierenversagen, aseptische Meningitis und schwere anaphylaktische Reaktionen dar. Besondere Erwähnung verdienen in diesem Rahmen Patienten mit selektivem IgA-Mangel, bei denen die Anwendung von IVIg kontraindiziert ist. In dieser Population liegen bei ca. 40 % der Betroffenen Anti-IgA-Klasse IgG oder, seltener, Klasse-IgE-Antikörper vor 26. Viele Patienten mit selektiver oder kombinierter kongenitaler Immundefizienz und Anti-IgA-Antikörpern scheinen jedoch im Besonderen die Verwendung von IVIg mit niedrigem IgA-Restanteil überraschend gut zu tolerieren 27. Durch Übertragung hämolysierender Antikörper kann in seltenen Fällen eine, klinisch meist milde, hämolytische Anämie auftreten. Es ist zu beachten, dass serologische Untersuchungen direkt im Anschluss an eine Behandlung mit IVIg nicht verlässlich sind. So werden beispielweise Hepatitis-B-Antikörpern übertragen, die serologisch eine Infektion vortäuschen 28. Durch die Bindung von Antigenen kann ferner die Effektivität einer Impfung unter IVIg reduziert sein. Da es sich bei IVIg um Blutprodukte handelt, besteht ein sehr geringes Risiko für die Transmission von Krankheitserregern.
Klinische Anwendung
Der therapeutische Benefit von IVIg in der Behandlung von Autoimmunkrankheiten konnte als Proof of Concept erstmals 1981 durch Imbach et al. 29 bei der ITP demonstriert werden. 1993 folgte die erste randomisierte kontrollierte Studie, die die erfolgreiche Anwendung von IVIg zur Behandlung der Dermatomyositis beschrieb 30. Weitere randomisierte Studien unterstreichen den Einsatz von IVIg in der Behandlung des Pemphigus vulgaris 31 und des bullösen Pemphigoids 32. Andere gängige dermatologische Indikationen sind das Skleromyxödem, ANCA-assoziierte Vaskulitiden, der systemische Lupus erythematodes und die toxische epidermale Nekrolyse (Tabelle 2). Hierbei erfolgt die Anwendung von IVIg zumeist off label als Zweit- oder Drittlinientherapie, wie in den aktuellen Leitlinien des European Dermatology Forum (EDF) ausgeführt 33. Da die Medikamentenkosten für einen einzelnen IVIg-Zyklus 10 000 € überschreiten können, sollte erwogen werden den Einsatz vorab bei den Krankenkassen auf individueller Basis zu beantragen. In Fallberichten wurde der Einsatz von IVIg bei einer Vielzahl weiterer Dermatosen beschrieben, für deren Diskussion auf die aktuellen Leitlinien des EDF 33 verwiesen wird. Da es sich vielfach um sehr seltene Indikationen handelt, kann das Vorliegen randomisierter Studien als notwendige Evidenz hierbei nicht in gleichem Maße wie für gängige Krankheitsbilder verlangt werden.
Tabelle 2. Evidenzgrad für die Behandlung ausgewählter dermatologischer Krankheitsbilder mit IVIg.
Randomisierte, kontrollierte Studien
|
Unkontrollierte Studien, Fallserien oder multiple Fallberichte
|
- *Kontroverse Indikation.
Die Anwendung von IVIg erfolgt in Anlehnung an Studienprotokolle zumeist in einer Dosierung von 2 g/kg Körpergewicht (KG)/Monat über jeweils 2–5 Tage. Das Ansprechen wird nach drei bis sechs Zyklen beurteilt. Stellt sich nach spätestens sechs Zyklen kein Therapieerfolg ein, sollte die IVIg-Behandlung abgebrochen werden. Bei gutem Ansprechen wird üblicherweise zunächst die immunsuppressive Begleittherapie auf eine Erhaltungsdosis reduziert, anschließend die IVIg-Infusionsintervalle bei gleichbleibender Einzeldosis gestreckt und letztlich die IVIg-Behandlung mit einem Auslassversuch abgeschlossen. Intervallverlängerungen auf mehr als sechs Wochen werden aufgrund der Halbwertszeit von IVIg (ca. 3 Wochen) nicht empfohlen 23. Bezüglich der Dosierung im Einzelfall sei auf Tabelle 3 verwiesen.
Tabelle 3. Dosierung von IVIg in der Behandlung ausgewählter dermatologischer Krankheitsbilder.
| Krankheitsbild | Dosis | Intervalle |
| Autoimmunbullöse Dermatosen | 2 g/kg KG über 2–5 Tage | 4-wöchentlich |
| Dermatomyositis | 2 g/kg KG über 2–5 Tage | 4-wöchentlich |
| Skleromyxödem | 2 g/kg KG über 2–5 Tage | 4-wöchentlich |
| ANCA-assoziierte Vaskulitiden | 2 g/kg KG über 2–5 Tage | 4-wöchentlich |
| Systemischer Lupus erythematodes | 0,4 bis 2 g/kg KG über 2–5 Tage | 4-wöchentlich |
| Toxische epidermale Nekrolyse | ≥ 3 g/kg KG über 3–5 Tage | einmalig |
Die Infusionsgeschwindigkeit kann von initial 0,01 ml/kg KG/min in etwa 30-minütigen Intervallen schrittweise auf maximal 0,08 bis 0,12 ml/kg KG/min erhöht werden. Nach unserer Erfahrung wird auch eine durchgängige Infusionsgeschwindigkeit von 266 ml/h unter Verwendung 10%iger IVIg-Lösung von den meisten Patienten sehr gut toleriert. Eine Verringerung der Infusionsgeschwindigkeit kann bei hochgradiger Herz- oder Niereninsuffizienz sowie bei Risikofaktoren für thromboembolische Ereignisse erforderlich werden. Bei Niereninsuffizienz kann zudem eine IVIg-Formulierung ohne den Begleitstoff Sucrose, welcher das Risiko einer osmotischen Schädigung der Niere birgt, vorteilhaft sein, während bei schwer kontrollierbarem Diabetes mellitus eine IVIg-Formulierung mit Maltose oder Glukose problematisch sein kann. Bei schweren kardiovaskulären Grunderkrankungen kann die Verwendung einer natriumarmen Formulierung, wie inzwischen bei den meisten Produkten umgesetzt, erwogen werden. Schleifendiuretika können das Risiko für nierenbezogene Nebenwirkungen erhöhen. Auf eine ausreichende Hydrierung der Patienten vor, während und nach der Infusion sollte ebenso wie auf die hiermit einhergehende, ausreichende Urinausscheidung geachtet werden. Während der Infusion erfolgen regelmäßige Blutdruckkontrollen. Vor jedem Zyklus erfolgt eine Blutentnahme, die Blutbild, Leber- und Nierenwerte beinhaltet und im Übrigen an die jeweilige Grunderkrankung angepasst ist. Vor Therapiebeginn können zudem virusserologische Untersuchungen sowie die Bestimmung der IgA-Serumspiegel erfolgen.
Autoimmunbullöse Dermatosen
Autoimmunbullöse Dermatosen, im Besonderen der Pemphigus vulgaris, stellen neben der Dermatomyositis die klassische Indikation für IVIg in der Dermatologie dar. Bei den autoimmunbullösen Dermatosen kommt es, in relevantem Maße humoral vermittelt, zu einer Immunantwort gegen epidermale Desmosomen (Pemphigusgruppe) oder Bestandteile der dermoepidermalen Junktionszone (Pemphigoidgruppe), die zum Verlust der epidermalen bzw. dermoepidermalen Integrität mit Blasen und Erosionen im Bereich der Haut und angrenzenden Schleimhaut führt. Unbehandelt führen Infektionen und Kachexie zu einer hohen Mortalität. In einzelnen Fällen bleibt die Therapie trotz Einsatz hochdosierter Glukokortikosteroide und adjuvanter Immunsuppressiva frustran.
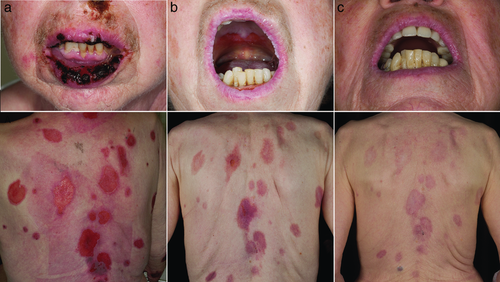
Für die Indikationen Pemphigus vulgaris, Pemphigus foliaceus und bullöses Pemphigoid besteht mit zwei randomisierten, kontrollierten klinischen Studien ein sehr hoher Evidenzgrad 31, 32. Abbildung 2 zeigt eine Patientin mit ausgeprägter oraler Beteiligung bei Pemphigus vulgaris vor und nach Behandlung mit adjuvanten IVIg. Die pathogenetische Relevanz spezifischer Autoantikörpern ist bei wenigen anderen dermatologischen Autoimmunerkrankungen ähnlich gut abgesichert wie bei Pemphigus vulgaris und bullösem Pemphigoid, sodass für den Einsatz von IVIg auch eine überzeugende pathophysiologische Rationale besteht. Im Analogieschluss sowie auf Basis von Fallserien und -berichten wird die Anwendung von IVIg auch für andere therapierefraktäre bullöse Autoimmundermatosen wie das Schleimhautpemphigoid oder die Epidermolysis bullosa acquisita empfohlen. In Anlehnung an die europäischen Leitlinien 33 werden IVIg üblicherweise als adjuvante Zweit- oder Drittlinientherapie nach Versagen einer kombinierten Behandlung mit hochdosierten systemischen Glukokortikosteroiden und steroidsparenden Immunsuppressiva, zumeist Mycophenolatmofetil oder Azathioprin, empfohlen 34-36. Die adjuvante Gabe von IVIg erfolgt hierbei unter gleichzeitiger Behandlung mit systemischen Glukokortikosteroiden, welche parallel zur Einleitung je nach Grunderkrankung auf 0,5–2 mg Prednisolonäquivalent/kg KG/Tag p.o. aufdosiert werden, und steroidsparenden Immunsuppressiva. Bei ausbleibendem Therapieansprechen nach 3–6 Zyklen sollte die Behandlung mit IVIg abgebrochen werden. Stellt sich ein therapeutischer Erfolg ein, worunter Abheilen der alten und ein ausbleibendes Auftreten neuer Blasen verstanden wird, wird zunächst das orale Steroid schrittweise auf 5 mg Prednisolonäquivalent/Tag reduziert, anschließend werden die adjuvanten Immunsuppressiva ausgeschlichen. Zuletzt werden die Intervalle der IVIg-Gaben auf bis zu sechs Wochen gestreckt und letztlich von einem Auslassversuch abgeschlossen.
Dermatomyositis
Bei der Dermatomyositis handelt es sich um eine Autoimmunerkrankung, die sowohl als idiopathische Myositis wie auch als Kollagenose klassifiziert werden kann. Ein klinischer Overlap mit anderen Kollagenosen, z. B. der systemischen Sklerose, und amyopathische Verläufe kommen vor. Es wird vermutet, dass ein zentrales pathogenetisches Element der Dermatomyositis eine antikörper- und komplementmediierte Mikroangiopathie ist 37. Neben einer proximalen Muskelschwäche treten klassische fliederfarbene Erytheme im Bereich lichtexponierter Areale, erythematöse bis erythematosquamöse Plaques über den Fingerknöcheln (Gottron-Papeln) sowie periokuläre Ödeme und prominente Veränderungen der Nagelfalzkapillaren auf. Da Herz- und Lungenbeteiligungen vorkommen und es sich in einem Drittel der Fälle um eine paraneoplastische Erkrankung handelt, ist die Mortalität verglichen mit anderen Kollagenosen hoch.
Wesentlicher Eckpfeiler der Behandlung der klassischen adulten Dermatomyositis ist der frühzeitige Einsatz hochdosierter Glukokortikosteroide (1–2mg Prednisolonäquivalent/kg KG/Tag p.o.). Entsprechend der aktuellen europäischen Leitlinie 33 ist der adjuvante Einsatz von IVIg, der durch eine kontrollierte, randomisierte Studie gut abgesichert ist 30, bereits nach Versagen einer Steroidmonotherapie gerechtfertigt. Hierbei wird der Beginn der Behandlung in der Regel mit einer erneuten Hochdosissteroidphase flankiert. Eine Verbesserung der Muskelkraft als wesentlicher Indikator für ein Therapieansprechen tritt in der Regel rasch ein, mit guten Resultaten bereits nach den ersten 3–4 Zyklen. Stellt sich nach sechs Zyklen kein Behandlungserfolg ein, sollte die Behandlung mit IVIg abgebrochen werden. Kutane Manifestationen sprechen, wie bei den meisten Therapiemodalitäten der Dermatomyositis, nicht selten verzögert bis unbefriedigend an. Im Verlauf wird je nach Therapieerfolg zunächst die Steroidbehandlung langsam auf eine Erhaltungstherapie von 5 mg/Tag reduziert, im Anschluss werden die IVIg-Gaben schrittweise bis auf 6-Wochen-Intervalle gestreckt und von einem Auslassversuch abgeschlossen. Alternativ zur Gabe von IVIg kann das immunsuppressive Regime um ein steroidsparendes Immunsuppressivum, üblicherweise Mycophenolatmofetil oder Azathioprin, ergänzt werden 38. In Ausnahmefällen (bei foudroyant verlaufender Dermatomyositis) kann der Einsatz von IVIg auch als Initialtherapie begleitend zu einer hochdosierten Steroidbehandlung gerechtfertigt sein 33. Auch bei der paraneoplastischen Dermatomyositis kann die adjuvante First-Line-Applikation von IVIg diskutiert werden. Es wurde postuliert, dass IVIg bei der Dermatomyositis ihre Wirksamkeit unter anderem durch die Inhibierung der Komplementkaskade entfalten 15.
Von der adulten Dermatomyositis ist die juvenile Dermatomyositis mit einem Erkrankungsgipfel um das 7. Lebensjahr, fehlender Tumorassoziation, häufiger Calcinosis cutis, bevorzugter Verwendung von Methotrexat als steroidsparendes Immunsuppressivum und besonders frühzeitigem Einsatz von IVIg zwecks Verhinderung langfristiger nebenwirkungsreicher immunsuppressiver Therapieverläufe abzugrenzen 38. Ebenfalls abweichend von oben geschildertem Schema wird die amyopathische Dermatomyositis, die je nach Serie 5–20 % der Fälle ausmacht, häufig initial mit Hydroxychloroquin, welchem eine vergleichsweise gute Wirkung auf die Hauterscheinungen zugesprochen wird, behandelt 38.
Skleromyxödem
Das Skleromyxödem ist eine chronisch-progrediente Ablagerungsdermatose unklarer Ätiologie. Auffällig ist die häufige Assoziation mit einer monoklonalen Gammopathie. Histomorphologisch zeigt sich eine Trias aus Fibroblastenproliferation, Fibrose und diffusen Muzinablagerungen in der Dermis. Klinisch zeigen sich, häufig symmetrisch und teils linear verteilte, wächserne Papeln und flächige Indurationen im Bereich des Gesichts, des Rumpfes und der Extremitäten. Die Stirn ist typischerweise stark betroffen und kann tiefe Furchen ausbilden (Facies leonina). Komplikationen umfassen dermatogene Kontrakturen sowie eine Beteiligung innerer Organe, im Besonderen des Nerven- und Herz-Kreislauf-Systems sowie der Gelenke, mit potenziell letalem Verlauf. Selten tritt eine akute Enzephalopathie mit begleitender Verschlechterung des Hautzustands und grippeartigen Prodromi auf (Dermato-Neuro-Syndrom).
Die Therapie des Skleromyxödems mit konventionellen Methoden wie systemischem Steroid, Thalidomid, Melphalan oder PUVA ist unbefriedigend und zum Teil mit relevanten Nebenwirkungen assoziiert. Obwohl die Evidenz für den Einsatz von IVIg ausschließlich auf Fallserien und -berichten und einer pathophysiologischen Rationale, namentlich der begleitenden Paraproteinämie, beruht, empfehlen die aktuellen europäischen Leitlinien daher IVIg als Erstlinientherapie bei schweren Fällen des Skleromyxödems 33, 39. Das Ansprechen ist üblicherweise erst nach sechs Monaten abschließend beurteilbar. Die Infusionen erfolgen zunächst in vierwöchigen Intervallen und können im Verlauf auf sechs Wochen gestreckt werden. Aufgrund häufiger Rezidive nach Absetzen der Behandlung ist nicht selten eine Dauertherapie erforderlich.
Systemische Vaskulitiden
Vaskulitiden werden entsprechend der Empfehlungen der Chapel-Hill-Konsensus-Konferenz unter anderem nach der Größe der überwiegend betroffenen Gefäße, nach systemischem oder rein isoliertem Organbefall und nach der Assoziation mit einer Grunderkrankung (primär vs. sekundär) eingeteilt 40. Im Bereich der Kleingefäßvaskulitiden werden von den Immunkomplexvaskulitiden die mit antineutrophilen zytoplasmatischen Antikörpern (ANCA), aber nur minimalen Immunkomplex-Ablagerungen entlang der Gefäßwände (pauci-immun) assoziierten Vaskulitiden abgegrenzt. Aufgrund der Evidenzlage soll letztere Gruppe, welche die Granulomatose mit Polyangiitis (Wegenersche Granulomatose), die eosinophile Granulomatose mit Polyangiitis (Churg-Strauss-Syndrom) und die mikroskopische Polyangiitis umfasst, näher vorgestellt werden. Den ANCA, die zur intravasalen Degranulation von neutrophilen Granulozyten führen können, wird hier eine wesentliche pathogenetische Rolle zugeschrieben. Die Beteiligung der inneren Organe, vornehmlich Niere und Lunge, ist prognosebestimmend. In 40–50 % treten retiforme Purpura, Ulzerationen und entzündliche Noduli der Haut auf. Die Mortalitätsrate ist langfristig auch unter immunsuppressiver Behandlung ca. 2–3-fach höher als in einer alters- und geschlechtsstandardisierten Vergleichskohorte, wobei vor allem im ersten Jahr nach Diagnosestellung bis zu 50 % der Differenz durch Infektionen erklärt werden können 41.
Aktuelle Empfehlungen zur Remissionsinduktion der schweren ANCA-assoziierten Vaskulitis sehen in erster Linie die Behandlung mit hoch dosierten Glukokortikosteroiden in Kombination mit Cyclophosphamid oder Rituximab vor 42. Die Anwendung von IVIg in der Behandlung von ANCA-assoziierten Vaskulitiden wird durch eine randomisierte, kontrollierte Studie 43, welche einen Behandlungszyklus mit einem Nachbeobachtungszeitraum von drei Monaten umfasste, und zahlreiche Fallberichte gestützt. In-vitro-Untersuchungen konnten zeigen, dass ANCA durch antiidiotypische Antikörper in IVIg neutralisiert werden 13. Entsprechend der aktuellen Leitlinie der EULAR werden IVIg bei ANCA-assoziierten Vaskulitiden im Besonderen bei moderater Restaktivität trotz Ausschöpfen der eingangs genannten Optionen adjuvant empfohlen 42. Weitere Fallberichte und -serien dokumentieren den erfolgreichen Einsatz von IVIg bei anderen systemischen Vaskulitiden. Nach Maßgabe der aktuellen europäischen Leitlinien sind IVIg daher allgemein bei schwerer systemischer Vaskulitis in therapierefraktären Fällen, wenn andere Therapieoptionen kontraindiziert sind, oder bei foudroyanten Verläufen zu erwägen 33. Die Gabe von IVIg erfolgt in der Regel adjuvant mit anderen Immunsuppressiva zunächst in vierwöchentlichen Intervallen, die im Verlauf auf bis zu sechs Wochen gestreckt werden können. Das Ansprechen sollte nach 3–6 Zyklen klinisch beurteilt werden. Abweichend hiervon wird bei dem Kawasaki-Syndrom, einer Systemvaskulitis der frühen Kindheit mit antibiotikaresistentem, hohem Fieber, mukokutaner, teils scarlatiniformer Hautbeteiligung und möglichen kardio- und zerebrovaskulären Komplikationen first line ein Zyklus IVIg in Kombination mit Acetylsalicylsäure gegeben 44.
Neben dem Einsatz bei systemischen Vaskulitiden dokumentieren größere Fallserien auch den erfolgreichen Einsatz von IVIg bei der Livedovaskulopathie, einer seltenen, äußerst schmerzhaften thrombotischen Vaskulopathie der Haut, die first line häufig durch Antikoagulation oder rheologisch wirksame Maßnahmen behandelt wird 45.
Systemischer Lupus erythematodes
Der systemische Lupus erythematodes (SLE) ist eine vielgestaltige Multisystemerkrankung, die im Regelfall eine fächerübergreifende Betreuung erfordert. Prominentes Merkmal ist die, möglicherweise UV-induzierte Produktion antinukleärer, vor allem gegen Doppelstrang-DNA gerichteter Antikörper, der eine pathogenetische Bedeutung zugeordnet wird. Spezifische Hautveränderungen sind der akut kutane, unter anderem durch das Schmetterlingserythem gekennzeichnete Lupus erythematodes, der chronisch-kutane Lupus erythematodes, meist mit diskoiden Plaques, sowie der subakut kutane Lupus erythematodes mit anulären und papulosquamösen Varianten. Unspezifische, häufig aber differenzialdiagnostisch hilfreiche kutane Merkmale beinhalten Photosensitivität sowie Schleimhautulzerationen im Bereich des harten Gaumens. Gefürchtete, potenziell letale Systemmanifestationen sind die Lupusnephritis und -enzephalitis.
Die leitliniengerechte Behandlung des SLE erfolgt organspezifisch und umfasst in erster Linie systemische Glukokortikosteroide, Quensyl bzw. Resochin, nichtsteroidale Antiphlogistika, Methotrexat, Azathioprin, Mycophenolatmofetil, Cyclophosphamid, Rituximab und Belimumab 46. Bei schwangeren SLE-Patientinnen mit rezidivierenden Aborten mit und ohne begleitendem Antiphospholipid-Syndrom konnte im Rahmen einer kontrollierten, randomisierten klinischen Studie durch IVIg eine reduzierte Frequenz von Aborten und eine Verbesserung des Lupus-Aktivitätsscores gezeigt werden 47. Eine weitere kontrollierte, randomisierte Studie zeigte eine Gleichwertigkeit der Behandlung mit IVIg und der Behandlung mit Cyclophosphamid bei der Lupusnephritis in einem Beobachtungszeitraum von 18 Monaten 48. Zu Bedenken ist hierbei jedoch, dass sich signifikante Unterschiede in der Effektivität verschiedener Therapien bei der Lupusnephritis mitunter erst nach fünf Jahren zeigen 49. Für eine Vielzahl weiterer Manifestationen existieren Fallserien und -berichte, für die auf gängige Leitlinien verwiesen wird 33. Entsprechend der Empfehlungen der EDF-Leitlinie stellen IVIg eine Therapieoption in allen Fällen des schweren systemischen Lupus erythematodes dar 33. Hervorzuheben ist hierbei der Einsatz in der Erhaltungstherapie der Lupusnephritis, der Behandlung des neuropsychiatrischen Lupus, der Lupus-assoziierten Immunthrombozytopenie und bei schwangeren Frauen 49. Hierbei variiert je nach Indikation die Dosierung zwischen 400 mg und 2 g/kg KG/Monat. Fallberichte dokumentieren zwar den Einsatz von IVIg bei therapierefraktärem subakut kutanem Lupus erythematodes, eine belastbare Indikation besteht abgesehen von Ausnahmefällen bei rein kutanen Manifestationen jedoch nicht 50.
Toxische epidermale Nekrolyse
Bei der toxischen epidermalen Nekrolyse (TEN) handelt es sich um eine schwere bullöse Hautreaktion, die zumeist arzneimittelinduziert ist und mit dem Stevens-Johnson-Syndrom, bei welchem eine weniger ausgeprägte Hautbeteiligung vorliegt, ein Kontinuum bildet. Histologisch zeigt sich in betroffenen Arealen eine Nekrose der gesamten Epidermis, die pathophysiologisch auf einen Influx zytotoxischer T-Zellen zurückgeführt wird. Die Mortalität der TEN liegt, je nach Anteil der betroffenen Körperoberfläche, zwischen 25 % und 70 %.
Die TEN stellt einen dermatologischen Notfall dar, der die sofortige Pausierung potenziell auslösender Medikamente sowie umfangreiche supportive Maßnahmen in einem Brandverletztenzentrum erfordert. Die Datenlage und somit der Stellenwert von IVIg in der Behandlung der TEN ist hoch kontrovers. Eine Hypothese besagt, dass IVIg Anti-FAS-Antikörper beinhalten, die Keratinozyten vor Apoptose schützen. Während ein rezentes systematisches Review mit Metaanalyse zu dem Ergebnis kam, dass keine Evidenz für den Einsatz von IVIg bei der TEN existiert und systemische Glukokortikosteroide oder Cyclosporin A zu bevorzugen sind 51, konnte in einem anderen, etwas älteren systematischen Review mit Metaanalyse eine inverse Korrelation zwischen IVIg-Dosis und Mortalität gezeigt werden 52. Nach Maßgabe der aktuellen europäischen Leitlinie kann der Einsatz von IVIg aufgrund des günstigen Nebenwirkungspotenzials zur Behandlung der TEN erwogen werden, wenn die Gabe frühzeitig und ausreichend hoch dosiert (≥ 3 g/kg KG) erfolgt 33.
Zusammenfassung
- ▸ IVIg werden aufgrund ihrer immunmodulatorischen Eigenschaften erfolgreich zur Behandlung dermatologischer Autoimmunkrankheiten eingesetzt.
- ▸ Die Herstellung folgt strengen Regularien, wobei die Gefahr einer viralen Transmission als sehr gering einzustufen ist.
- ▸ Häufigere Nebenwirkungen stellen Kopfschmerzen, Übelkeit, Fatigue und eine febrile Infusionsreaktion dar.
- ▸ Sehr selten kommt es zum Auftreten schwerer Nebenwirkungen wie thromboembolischen Ereignissen, anaphylaktischem Schock oder akutem Nierenversagen.
- ▸ Aufgrund der Therapiekosten sollte erwogen werden, den dermatologischen Einsatz von IVIg vorab bei der Krankenkasse zu beantragen.
- ▸ IVIg werden bei dermatologischen Indikationen in einer Dosierung von 2 g/kg KG über 2–5 Tage alle vier Wochen infundiert.
- ▸ Eine Dosisreduktion erfolgt im Verlauf bei gutem Ansprechen durch Verlängerung der Infusionsintervalle auf bis zu sechs Wochen, gefolgt von einem Auslassversuch.
- ▸ Bei bullösen Autoimmundermatosen kann der adjuvante Einsatz von IVIg als Zweit- oder Drittlinientherapie nach Versagen einer kombinierten immunsuppressiven Therapie erfolgen.
- ▸ IVIg können in der Behandlung der Dermatomyositis als adjuvante Zweitlinientherapie bereits nach Versagen einer Steroidmonotherapie eingesetzt werden.
- ▸ Aufgrund mangelnder Therapiealternativen können IVIg bei schweren Verläufen des Skleromyxödems als Erstlinientherapie erwogen werden.
- ▸ In therapierefraktären Fällen einer schweren systemischen Vaskulitis kann die Anwendung von IVIg erwogen werden.
- ▸ Schwere Fälle von systemischem Lupus erythematodes können eine Therapieindikation für IVIg darstellen.
- ▸ Der Einsatz von IVIg zur Behandlung der toxischen epidermalen Nekrolyse kann erwogen werden.
Interessenkonflikt
A.E.: Beratertätigkeit für Biotest, MSD Oncology, Galderma, Janssen Cilag, AbbVie und Bristol-Myers Squibb. Honoraria von Bristol-Myers Squibb und Roche Pharma. J.H. gibt keine Interessenkonflikte an.
Literatur
Fragen zur Zertifizierung durch die DDA
- Welche der folgenden Aussagen zu Immunglobulin G trifft nicht zu?
- 75 % aller Immunglobuline im menschlichen Blut gehören zur Subklasse IgG.
- IgG-Antikörper bestehen jeweils aus zwei identischen schweren und zwei identischen leichten Ketten.
- Die schwere Kette ist ausschließlich aus konstanten Regionen zusammengesetzt.
- Das F(ab)2-Fragment trägt die antigenbindende Domäne.
- Das Fc-Fragment dient u. a. der Komplementaktivierung und Rezeptorbindung.
- Welche der folgenden Aussagen über zum Zwecke der Immunmodulation in der Dermatologie genutzte polyklonale Immunglobuline trifft zu?
- Die Immunglobuline werden aus gepooltem Plasma von bis zu 100 Spendern gewonnen.
- Der Einsatz erfolgt grundsätzlich nur als Zweit- oder Drittlinientherapie.
- Meist erfolgt der Einsatz als subkutanes Immunglobulin G (SCIg).
- Die Dosis ist niedriger als zur Substitution bei Immundefizienz.
- Es existiert eine gute Evidenzlage für die Behandlung mehrerer dermatologischer Krankheitsbilder.
- Welche der folgenden Aussagen zur Herstellung von IVIg trifft nicht zu?
- Mittels moderner Mehrschrittverfahren können bis zu 4,5 g IgG aus einem Liter Plasma gewonnen werden.
- Das Plasma wird aus Vollblut sowie durch Plasmapherese gewonnen.
- Ein besonderes Augenmerk liegt auf einem möglichst geringen IgA-Gehalt.
- Aufgrund von Screeningmaßnahmen sowie als Folge moderner Herstellungsverfahren ist das Transmissionsrisiko für virale Erkrankungen sehr gering.
- IVIg werden heutzutage kommerziell überwiegend als gefriergetrocknetes Pulver vertrieben.
- Welche der folgenden Aussagen beschreibt keine postulierte Wirkweise von IVIg?
- Verdrängung von Autoantikörpern aus protektiver FcRn-Bindung
- Hochregulation inhibitorischer FcγRIIB-Rezeptoren.
- Neutralisierung körpereigener Autoantikörper durch antiidiotypische Antikörper.
- Neutralisierung von Komplementfaktoren.
- Expansion von Th17 Zellen.
- Zu den häufigen Nebenwirkungen von IVIg zählen nicht.
- makulopapulöses Exanthem
- Kopfschmerzen
- Übelkeit
- febrile Infusionsreaktion
- Fatigue
- Welche der folgenden Aussagen zu den Nebenwirkungen der IVIg-Behandlung trifft nicht zu?
- Bei Patienten mit IgA-Mangel kann es vermehrt zum Auftreten schwerer anaphylaktischer Reaktionen kommen.
- Seltene Nebenwirkungen sind u. a. thromboembolische Ereignisse inklusive Myokardinfarkt, Lungenembolie und Apoplex, Nierenversagen, Hypervolämie und Hämolyse.
- Für das Auftreten thromboembolischer Ereignisse werden u. a. Veränderungen der Fließeigenschaften des Bluts durch IVIg verantwortlich gemacht.
- Serologische Untersuchungen sind auch direkt im Anschluss an eine IVIg-Gabe uneingeschränkt auswertbar.
- Die häufiger auftretenden Nebenwirkungen lassen sich meist symptomatisch beherrschen.
- Welche der folgenden Aussagen zum therapeutischen Einsatz von IVIG trifft nicht zu?
- Bei Herzinsuffizienz, chronischem Nierenversagen und Risikofaktoren für thromboembolische Ereignisse kann eine Reduktion der Infusionsgeschwindigkeit notwendig sein.
- In der Dermatologie werden IVIg meist in einer Dosierung von 2 g/kg Körpergewicht über 2–5 Tage alle vier Wochen infundiert.
- Wichtig ist eine ausreichende Hydrierung der Patienten vor, während und nach der Infusion.
- IVIg werden seit weniger als zehn Jahren zur Behandlung von Autoimmunerkrankungen eingesetzt.
- Während der Infusion empfehlen sich regelmäßige Blutdruckkontrollen.
- Der Einsatz von IVIg bei welchem der folgenden Krankheitsbilder ist nicht untersucht durch randomisierte, kontrollierte klinische Studien?
- Pemphigus vulgaris
- Pemphigus foliaceus
- bullöses Pemphigoid
- Dermatomyositis
- toxische epidermale Nekrolyse
- IVIg sind nach den aktuellen europäischen Leitlinien 33 im Regelfall nicht indiziert zur Behandlung …
- eines Pemphigus vulgaris oder bullösen Pemphigoids nach Versagen einer kombinierten immunsuppressiven Therapie.
- einer ANCA-assoziierten Vaskulitis als Erstlinientherapie.
- einer Dermatomyositis nach Versagen einer Steroidmonotherapie oder einer kombinierten immunsuppressiven Behandlung.
- einer toxischen epidermalen Nekrolyse als Einzelfallentscheidung.
- eines schweren Skleromyxödems als Erstlinientherapie.
- Für den Einsatz von IVIg beim Skleromyxödem trifft zu.
- Mit systemischen Glukokortikosteroiden und Chemotherapeutika stehen Alternativoptionen mit sehr guter Evidenz zur Verfügung.
- Die Behandlung ist im Regelfall nach drei Monaten abgeschlossen.
- Rückfälle nach Absetzen der IVIg-Behandlung treten fast nie auf.
- Aufgrund der häufig begleitenden Paraproteinämie ergibt sich eine pathophysiologische Rationale.
- Es besteht eine formale Zulassung.
Liebe Leserinnen und Leser, der Einsendeschluss an die DDA für diese Ausgabe ist der 31. Januar 2018. Die richtige Lösung zum Thema „1 × 1 der Dermatohistologie. Teil 2 – Tumoren der Haut“ in Heft 9 (September 2017) ist: (1e, 2b, 3d, 4c, 5a, 6b, 7d, 8b, 9d, 10c).
Bitte verwenden Sie für Ihre Einsendung das aktuelle Formblatt auf der folgenden Seite oder aber geben Sie Ihre Lösung online unter http://jddg.akademie-dda.de ein.




