Die Bedeutung von humanen 6-sulfo LacNAc dendritischen Zellen (slanDCs) bei Autoimmunität und Tumorerkrankungen
Zusammenfassung
Dendritische Zellen spielen eine wichtige Rolle bei der Regulation immunologischer Reaktivität. Die Existenz funktionell spezialisierter Populationen dendritischer Zellen der Haut ist eine Konsequenz der unterschiedlichen Qualität von Angriffen auf unseren Organismus. Als slanDCs werden inflammatorische dendritische Zellen des Menschen bezeichnet, die sich durch die spezifische Expression des Zuckers 6-sulfo LacNAc (slan) auszeichnen. Nach phänotypischer Maturation besitzen slanDCs die Fähigkeit zur Produktion großer Mengen proinflammatorischer Mediatoren wie IL-12, TNF-α, IL-1β und IL-23. Aktuelle Daten beschreiben eine mögliche Bedeutung dieser proinflammatorischen Zellen bei so unterschiedlichen Erkrankungen wie der Psoriasis, dem Lupus erythematodes aber auch Tumorerkrankungen und eröffnen dadurch neue Felder der Pathogeneseforschung. Zudem wurde als Basis einer gezielten therapeutischen Manipulation ein slanDC-spezifisches Targeting-System entwickelt. Zukünftige Herausforderungen liegen in der Erarbeitung eines besseren Verständnisses der spezifischen Bedeutung von slanDCs für die Regulation der unspezifischen und spezifischen Immunantwort sowie einer Translation dieses Wissens in therapeutische Optionen.
Einleitung
Die Untersuchung dendritischer Zellen (DCs) des Menschen hat in den vergangenen Jahren einen raschen Wissenszuwachs erlebt. Hierbei hat sich das System der DCs der Haut als eine komplexe und dynamische Komponente des kutanen Immunsystems erwiesen. Ging man zunächst davon aus, dass DCs der Haut allein durch Langerhans-Zellen der Epidermis repräsentiert werden, haben spätere Arbeiten klar gezeigt, dass auch die Dermis ein dichtes System von unterschiedlichen DCs und verwandten Zellen sowie Makrophagen beherbergt, die phänotypisch zum Teil nur schwer voneinander zu unterscheiden sind. Neuere Daten aus der Maus zeigen, dass sich das Langerhans-Zell-Netzwerk der Epidermis unabhängig von hämatopoetischen Stammzellen etabliert und auf fetale Vorläuferzellen zurückgeht, die sich lokal durch Proliferation selbst erneuern . Damit wären Langerhans-Zellen zumindest ontogenetisch keine klassischen DCs (die von hämatopoetischen Stammzellen des Knochenmarks abstammen), auch wenn sie funktionell betrachtet Eigenschaften mit DCs teilen .
Im Blut des Menschen unterscheidet man zwei Subtypen klassischer, auf hämatopoetische Stammzellen des Knochenmarks zurückgehende DCs: CD1c+ DCs (mDC1) und CD141+ DCs (mDC2), die beide auch in der Haut vorkommen . Daneben finden sich im Blut ebenfalls auf hämatopoetische Stammzellen des Knochenmarks zurückgehende plasmazytoide dendritische Zellen (pDC), die in der gesunden Haut kaum zu finden sind, bei Entzündungen aber rekrutiert werden können . Darüber hinaus finden sich in der Haut CD14+-Zellen, die wahrscheinlich von Monozyten abgeleitet sind und eine phänotypisch heterogene Population darstellen. Unter entzündlichen Bedingungen können auch diese Zellen ausgesprochen proinflammatorisch reagieren . Während Langerhans-Zellen im Wesentlichen auf die Epidermis beschränkt sind, besiedeln DCs, inklusive der slanDCs, die obere Dermis (0–20 μm unterhalb der dermoepidermalen Junktionszone). Zudem finden sich in der tieferen Dermis Makrophagen (40–60 μm unterhalb der dermoepidermalen Junktionszone), die in der Mehrzahl mit Gefäßen assoziiert zu sein scheinen .
Als slanDCs werden inflammatorische DCs des Menschen bezeichnet, die sich durch die spezifische Expression der Kohlenhydratmodifikation 6-sulfo N-Acetyllactosamin (6-sulfo LacNAc, slan) identifizieren und charakterisieren lassen . Der namengebende Zucker ist ein terminales, O-glykosidisch gebundenes, sulfatiertes Disaccharid auf PSGL-1, einem bedeutenden Adhäsionsmolekül auf Immunzellen . Im Gegensatz zu slanDCs exprimieren CD1c+ DCs und pDCs das cutaneous lymphocyte antigen (CLA), was in einem spezifischen Bindeverhalten von Selektinen resultiert. slanDCs zeigen im Blut einen immaturen Phänotyp, reifen aber nach ihrer Isolation spontan zu professionellen antigenpräsentierenden Zellen mit der Fähigkeit zur Stimulation naiver T-Zellen aus. Während der Maturation entwickeln slanDCs einen Phänotyp inflammatorischer DCs, der sich durch eine Aufregulation typischer Maturationsmarker (CD40, CD80, CD83, CD86, HLA-DR) und eine starke Stimulierbarkeit durch pathogen-associated molecular patterns (PAMPs) auszeichnet . In der Konsequenz führt die Stimulation von slanDCs mit verschiedenen TLR-Liganden zur Produktion großer Mengen proinflammatorischer Zytokine wie IL-12, TNF-α, IL-6, IL-β und IL-23 . Dieses Zytokinprofil bewirkt in Kokulturen eine Programmierung von Th1- und Th17-T-Zellen, Subtypen von Effektor-T-Zellen die bekanntermaßen pathogenetisch relevante Komponenten bei verschiedenen Autoimmunerkrankungen wie der Psoriasis, der rheumatoiden Arthritis und dem Lupus erythematodes darstellen.
Im Folgenden werden aktuelle Daten diskutiert, die für eine Rolle von slanDCs bei chronisch entzündlichen Erkrankungen und Autoimmunerkrankungen der Haut sprechen. Anschließend wird auf einige neu in Erscheinung tretende Aspekte der DC-Biologie eingegangen.
Psoriasis
Die Psoriasis ist im Vergleich zu anderen Autoimmunerkrankungen der Haut relativ gut untersucht. Zwar sind ihre Ursachen komplex und sowohl in Umwelt- als auch genetischen Faktoren zu suchen, die je nach betroffener Person eine unterschiedliche Rolle spielen können, doch sind zumindest die zellulären Mechanismen der Entstehung psoriatischer Plaques vergleichsweise gut verstanden. Vermittelt scheint sie durch Wechselwirkungen von DCs, T-Zellen und Keratinozyten zu sein. Dabei ist in frühen Läsionen die Produktion von IFN-α durch pDCs sowie IL-12 und IL-23 durch mDCs von Bedeutung. In chronischen Läsionen spielt dagegen die Produktion von IL-12 und IL-23 durch mDCs und inflammatorische DCs sowie die Aktivität von Th1-, Th17- und Th22-T-Zellen eine entscheidende Rolle . Dabei wurden inflammatorische DCs ursprünglich über ihre Expression des DC-Markers CD11c und die Abwesenheit der Marker für CD1c+ DCs und CD141+ DCs definiert. Eine der intensiv untersuchten Populationen inflammatorischer DCs sind die TNF- und iNOS-produzierenden DCs (TIP-DCs) , die durch ihre charakteristische Expression von TNF-α und iNOS zum Teil mit slanDCs überlappen.
Die Frequenz von slanDCs in gesunder Haut ist niedrig . Zahlreiche slanDCs lassen sich dagegen bei der Psoriasis nachweisen, wo sie sich überwiegend in der papillären Dermis, einer für DCs typischen Lokalisation, befinden . slanDCs der psoriatischen Plaques zeigen einen deutlich aktivierten Phänotyp und sind zu einem großen Teil positiv für IL-23, TNF-α und iNOS . Damit weisen slanDCs einen Phänotyp auf, der für eine Bedeutung bei der Aufrechterhaltung der chronischen Entzündung spricht. In-vitro-Experimente mit isolierten slanDCs konnten deren Fähigkeit zur Produktion proinflammatorischer Zytokine (IL-1β, IL-23, IL-12 und IL-6) mit Potenzial zur Programmierung von Th1- und Th17-T-Zellen bestätigen. slanDC-T-Zell-Kokulturen konnten schließlich auch zeigen, dass durch slanDCs induzierte T-Zellen als sogenannte Th17/Th1-T-Zellen charakterisiert werden können, die eine aktive Produktion von IL-17, IL-22, TNF-α und IFN-γ zeigen. Somit deutet sowohl das Zytokinprofil der slanDCs als auch dasjenige der slanDC-stimulierten Effektor-T-Zellen auf eine pathogenetische Relevanz der slanDCs bei der Aufrechterhaltung chronischer Plaques hin (Abbildung ). Interessant ist in diesem Zusammenhang, dass eine erfolgreiche Behandlung der Psoriasis mit dem TNF-α-Antagonisten Etanercept zu einer starken Reduktion der Frequenz von slanDCs in abheilenden Läsionen führt . Die wenigen in der Haut verbliebenen slanDCs exprimieren weiterhin TNF-α und IL-23 und könnten so für ein rasches Rezidiv nach Absetzen des Medikaments verantwortlich sein .

Die Bedeutung von slanDCs bei der Initiierung entzündlicher Läsionen kann derzeit nicht beurteilt werden. Es ist aber beachtenswert, dass slanDCs in Gegenwart des antimikrobiellen Peptids LL37 (Cathelicidin) und von RNA effektiv zur Produktion von TNF-α angeregt werden können. Komplexe aus LL37 und Nukleinsäuren wurden mit der Entstehung psoriatischer Plaques in Verbindung gebracht . Es ist deshalb möglich, dass slanDCs sowohl zur Entstehung als auch zur Aufrechterhaltung der Plaques beitragen. Da neben myeloiden DCs besonders die pDCs bei der Entstehung psoriatischer Plaques von Bedeutung zu sein scheinen, wäre es hier interessant, die Wirkung von Faktoren der pDCs auf slanDCs zu untersuchen. Dabei muss besonders die Fähigkeit der pDCs zu Produktion großer Mengen von Typ-I-Interferonen berücksichtigt werden (Abbildung ).
Es ist bekannt, dass slanDCs mit neutrophilen Granulozyten und NK-Zellen interagieren und dadurch ihre proinflammatorische Funktion deutlich verstärkt wird . An dieser positiven Rückkopplung sind sowohl kontaktabhängige (CD18/ICAM-1) als auch zytokinvermittelte (IL-12, IFN-γ) Signale beteiligt. Eine Kolokalisation von slanDCs, neutrophilen Granulozyten und NK-Zellen ist in-vivo im entzündlichen Infiltrat der Psoriasis und des Morbus Crohn beschrieben worden. Da neutrophile Granulozyten in der frühen Phase der Psoriasis eine bisher unterschätzte autoinflammatorische Rolle spielen könnten , sollten zukünftige Arbeiten auch die Wechselwirkungen dieser Zelltypen in der Psoriasis berücksichtigen.
Lupus erythematodes
Lupus erythematodes (LE) ist die Bezeichnung für eine Gruppe von kutanen und systemischen Autoimmunerkrankungen, die mit der Bildung von Autoantikörpern gegen verschiedene nukleäre Antigene einhergehen. Autoantigene des LE können die DNA selbst, nukleäre Proteine, aber auch RNA enthaltende sogenannte Ribonukleoproteine sein. Typisch für den LE ist eine Ablagerung von Autoimmunkomplexen im Gewebe, aber auch im Gefäßbett. Diese Immunkomplexe stimulieren Fc-Rezeptor-tragende Immunzellen und tragen dadurch selbst zur Pathogenese der Krankheit bei. Eine wichtige Rolle bei der Entwicklung des LE wird den pDCs zugeschrieben, die nach Stimulation durch Nukleinsäuren oder nukleinsäurehaltige Immunkomplexe IFN-α sezernieren . Daneben wurde eine mögliche Rolle von Th1- und Th17-T-Zellen beschrieben, was auf eine Aktivität myeloider DCs hindeutet .
Eine erhöhte Frequenz von slanDCs konnte in verschiedenen Subtypen des LE (chronisch diskoidem LE, subakut kutanem LE, systemischem LE) nachgewiesen werden. Dabei waren slanDCs nicht nur verstreut in der Dermis zu finden, sondern waren häufig mit Lymphfollikel-ähnlichen Strukturen assoziiert, innerhalb derer sie mit T-Zellen, jedoch nicht mit B-Zellen kolokalisierten. Als Hinweis auf ihre Aktivierung exprimierten slanDCs in diesen Läsionen TNF-α .
slanDCs zeigen mindestens zwei phänotypische Merkmale, die von funktioneller Bedeutung für die Pathogenese des LE sind. Im Gegensatz zu anderen humanen DCs exprimieren slanDCs zwei Rezeptoren für IgG-Immunkomplexe (CD16/FcγRIII und CD32/FcγRII), weshalb sie mit einer hohen Kapazität zur Bindung von Immunkomplexen ausgestattet sind. Von slanDCs gebundene Immunkomplexe werden internalisiert, prozessiert und antigenische Peptide auf MHC-Molekülen präsentiert, wodurch antigenspezifische T-Zellen stimuliert werden können . Zusätzlich zeigen slanDCs im Gegensatz zu CD1c+ DCs und pDCs eine Koexpression von TLR7 und TLR8, exprimieren somit zwei endosomale Pattern-Recognition-Rezeptoren für einzelsträngige RNA. Beide Rezeptoren sind funktional und die Stimulation beider Rezeptoren führt zu einer effektiven Produktion von TNF-α und IL-12 . Dementsprechend kann Serum von LE-Patienten, das als stimulatorische Komponenten nukleinsäurehaltige Immunkomplexe enthält , im Gegensatz zum Serum gesunder Spender, eine TNF-α-Produktion durch slanDCs induzieren .
Im LE, wie auch in der Psoriasis, findet sich eine erhöhte Konzentration des kationischen, antimikrobiellen Peptids LL37 (Cathelicidin). LL37 kann Nukleinsäuren binden und diese stabilisieren. In höheren Konzentrationen kann LL37 die Aufnahme von Nukleinsäuren durch körpereigene Zellen fördern. In diesem Zusammenhang ist interessant, dass slanDCs im Vergleich zu CD1c+ DCs eine deutlich höhere Produktion von TNF-α nach Stimulation mit RNA und LL37 zeigen .
Tumorerkrankungen
Auch im zellulären Milieu von Tumoren finden sich DCs. Allerdings scheinen diese durch immunsuppressive Faktoren des Tumors in ihrer Funktion gestört zu sein, was als ein Grund für die fehlende Induktion effektiver tumorspezifischer Immunreaktionen angesehen wird. Für die Aufdeckung von Wegen zum Durchbrechen der tumorinduzierten immunologischen Toleranz spielt daher ein besseres Verständnis tumorassoziierter DCs eine bedeutende Rolle .
In einer kürzlich publizierten Arbeit wurden slanDCs mit einer neuen Form der Tumor-Immunosurveillance oder des Tumor-Immunoeditings bei Karzinomerkrankungen in Verbindung gebracht . In dieser Untersuchung wurden verschiedene Primärtumoren sowie metastatische, Tumor- drainierende Lymphknoten untersucht. Primärtumoren zeigten nur selten eine Infiltration von slanDCs, während metastatische drainierende Lymphknoten eine Rekrutierung von slanDCs entlang des metastasierten Tumorgewebes aufwiesen. Durch Analyse von metastatischen und nicht-metastatischen Sentinel-Lymphknoten von Brustkrebspatientinnen konnte zudem gezeigt werden, dass slanDCs erst nach Ankunft der Tumorzellen in die Lymphknoten rekrutiert werden. Im metastatischen Lymphknoten schienen andere DCs trotz einer erhöhten Zellzahl ihre spezifische intranodale Lokalisation zu behalten, während slanDCs in sehr enge räumliche Nähe zu Tumorzellen rekrutiert wurden und dadurch an der Schnittstelle zwischen Tumorzellen und T-Lymphozyten lokalisiert waren. Die so positionierten slanDCs hatten Kontakt mit apoptotischen Tumorzellen, sodass slanDCs den T-Lymphozyten potenziell Tumorantigene präsentieren könnten. Erwähnenswert ist hier, dass slanDCs in vitro tumorspezifische zytotoxische T-Zellen induzieren können . Innerhalb der Lymphknoten waren die T-Zellen jedoch größtenteils positiv für GATA-2 und waren damit wahrscheinlich Th2-polarisiert, was als Escape-Mechanismus des Tumors interpretiert wurde. Berücksichtigt man jedoch, dass slanDCs aus dem Blut von Karzinompatienten im Gegensatz zu anderen DCs nicht in ihrer Funktion beeinträchtigt waren, müssen slanDCs als mögliche Zielstruktur für gerichtete Tumortherapien betrachtet werden. Eine gegen Tumorzellen gerichtete Immunreaktivität konnte für slanDCs auf unterschiedlichen Ebenen, auch unabhängig von ihrer Fähigkeit zur Antigenpräsentation, gezeigt werden: effektive antikörperabhängige zellvermittelte Zytotoxizität (ADCC) , direkte gegen Tumorzellen gerichtete Zytotoxizität und eine ausprägte Stimulation der tumorgerichteten NK-Zell-vermittelten Zytotoxizität . Interessanterweise liegt in metastatischen Lymphknoten eine Kolokalisation von slanDCs mit NK-Zellen und neutrophilen Granulozyten vor.
Therapeutischer Kontext
Für humane DCs existieren gegenwärtig keine zugelassenen zelltypspezifischen Therapien. Ein experimentelles, aus zwei Komponenten rekombinanter Proteine bestehendes, modulares Targeting-System für slanDCs wurde von M. Bachmann (Dresden) entwickelt (Abbildung ). Eine der beiden Komponenten ist ein bispezifischer Diabody (scBsDb) mit einer Spezifität für das slan-Epitop und einer Spezifität für die zweite Komponente des Systems, einem Peptidrückgrat. Dieses Peptidrückgrat trägt mehrere Bindestellen für den Diabody, sodass eine erhöhte Avidität durch multivalente Bindung erreicht wird. Neben den Bindestellen für den Diabody kann das Peptid ein Antigen tragen. Sind beide Komponenten des Targeting-Systems und slanDCs vorhanden, können die slanDCs spezifisch mit dem Antigen beladen werden. Zur Testung der Funktionalität dieses Systems wurde ein Peptidrückgrat mit einem Tetanus-Toxin-Peptid verwendet. slanDCs wurden mit den Komponenten des Targeting-Systems vorinkubiert, anschließend gewaschen und danach mit autologen T-Zellen kultiviert. Das Targeting der slanDCs mit einer relativ geringen Konzentration des Antigens führte so in der Kokultur zur effizienten Reaktivierung Tetanus-Toxin-spezifischer Memory-T-Zellen .
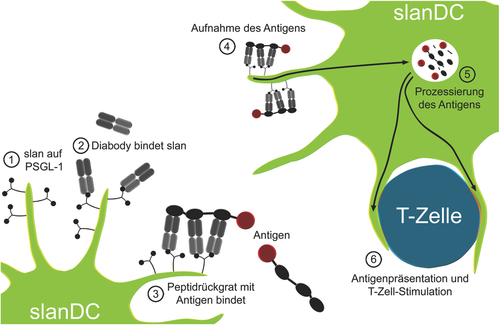
Das Potenzial solcher Targeting-Systeme liegt auf der Hand. Geeignet wären sie für neuartige Vakzinierungen gegen Infektionskrankheiten und in der experimentellen Tumortherapie. Außerdem ist eine Kopplung von Chemo- oder anderen Therapeutika an das Peptidrückgrat denkbar, wodurch eine spezifische Manipulation der slanDCs erreicht würde.
Schlussbemerkungen
slanDCs zeigen einen außerordentlich proinflammatorischen Charakter und erscheinen in den bisher beschriebenen Erkrankungen häufig als inflammatorische DCs. Dieser proinflammatorische Charakter und bestimmte phänotypische und funktionelle Merkmale legen zumindest für die Psoriasis und den Lupus erythematodes eine pathogenetische Relevanz der slanDCs nahe. Grundsätzlich sollte davon ausgegangen werden, dass die Rekrutierung von slanDCs als inflammatorische DCs nicht auf die hier beschriebenen Krankheiten beschränkt ist. Weitere bekannte Beispiele für die Gegenwart von slanDCs sind entzündliche Tonsillen , das Ileum von Patienten mit Morbus Crohn , die entzündete Synovia der rheumatoiden Arthritis sowie die intestinale Graft-versus-Host-Disease .
Neben der hier beschriebenen Rolle von slanDCs bei Autoimmunerkrankungen hat sich das Forschungsfeld zur slanDC-Biologie in jüngster Zeit erweitert. Dazu gehört insbesondere die neu aufgedeckte mögliche Rolle von slanDCs in der Immunosurveillance oder dem Immunoediting bei metastatischen Karzinomen . Daneben zeigen slanDCs auch in bestimmten Viruserkrankungen wie HIV ein spezifisches Reaktionsmuster . Nicht zuletzt scheinen slanDCs durch die Koexpression zweier Immunkomplexrezeptoren eine Spezialisierung für die Detektion und Verarbeitung von Immunkomplexen aufzuweisen . Mit der Weiterentwicklung der Ideen zum spezifischen Targeting von slanDCs wird in Zukunft schließlich auch eine Translation des Wissen in slanDC-spezifische Therapien möglich werden.
Finanzierung
Diese Arbeit wurde unterstützt durch Mittel des Sonderforschungsbereichs (SFB) 938 (T.D. und K.S.).
Interessenkonflikt
Keiner.




