Mykologie – ein Update Teil 2: Dermatomykosen: Klinisches Bild und Diagnostik
Redaktion
Prof. Dr. Jan C. Simon, Leipzig
Dermatophyten sind die Ursache von Dermatophytosen oder der Tinea.
Die Tinea pedis gilt als häufigste Pilzinfektion in Deutschland, an zweiter Stelle folgt die Tinea unguium.
Die Tinea capitis ist eine wieder sehr aktuelle Infektion bei Kindern und Jugendlichen.
Die Tinea incognito, auch Tinea atypica bezeichnet, ist häufiger als vermutet Ursache einer scheinbar therapieresistenten Dermatose.
Candidosen der Haut betreffen die intertriginösen Hautareale, neben den groଂen Körperfalten die Interdigital-Räume der Finger und Zehen.
Die mikroskopische Diagnostik mit dem Kalilaugen-Präparat kann heute durch das empfindlichere fluoreszenzoptische Präparat Calcofluor® oder Blankophor® ergänzt oder sogar ersetzt werden.
Die molekularbiologische Dermatophyten-Diagnostik mit Nukleinsäure-Amplifikationstechniken (Polymerasekettenreaktion) hat sich zunehmend auch in der Dermatomykologie etabliert.
Das klinische Bild einer Dermatophytose ist nicht erregerspezifisch, d. h. verschiedene Dermatophyten-Arten können der Tinea pedis, aber auch jeder anderen Tinea-Form zugrunde liegen.
Erreger der Tinea pedis sind anthropophile Dermatophyten: Trichophyton rubrum und Trichophyton interdigitale (anthropophile Stämme) sowie Epidermophyton floccosum.
Die sogenannten Mokassin-Form der Tinea pedis ist klinisch schwer vom atopischen Fuଂekzem oder der Psoriasis plantaris zu unterscheiden.
Um bei Verdacht auf Tinea pedis entzündliche Dermatosen, z. B. das dyshidrosiforme Fuଂekzem oder Kontaktekzeme differenzialdiagnostisch auszuschlieଂen, sollte in jedem Fall eine mykologische Untersuchung erfolgen.
Tinea corporis und Tinea capitis werden im Englischen als ringworm bezeichnet.
In Südostasien, aber auch in Afrika und Süd-Amerika kennt man die Tinea imbricata (Tokelau) durch Trichophyton concentricum.
Der alte Begriff des “Eczema marginatum (Hebra)” entspricht der Tinea inguinalis.
Die Tinea incognito wird zunächst fälschlicherweise meist als infektiöse und entzündliche Dermatose angesehen und antientzündlich mit topischen Glukokortikoiden behandelt.
Per definitionem ist die Tinea incognito eine Dermatophyten-Infektion, bei der infolge einer ungerechtfertigten Anwendung von topischen Glukokortikoiden oder Calcineurininhibitoren das typische klinische Erscheinungsbild verloren gegangen ist.
Beim T.-rubrum-Syndrom sind mindestens vier Lokalisationen des Körpers betroffen, die Füଂe (plantar), Hände (palmar), Nägel sowie eine weitere Lokalisation am Integument.
Kriterium für die Diagnosestellung T.-rubrum-Syndrom ist der mikroskopische Pilznachweis (KOH oder Blankophor®) von allen vier Lokalisationen sowie der kulturelle Nachweis von T. rubrum aus mindestens drei der vier Lokalisationen der Tinea.
Die bullöse Tinea ist selten, gelegentlich findet man sie im Rahmen einer Tinea manus oder Tinea corporis.
Eine Pilzinfektion der linken Hand und beider Füଂe, oft unter Einbeziehung der Finger- und Zehennägel, wird als “One-Hand/Two-Feet-Mykose” (OHTFM) bezeichnet.
Ursache der “One-Hand/Two-Feet-Mykose” ist die ‹bertragung des Dermatophyten von der Tinea pedis oder Onychomykose auf die (linke) Hand, beispielsweise beim Kratzen.
Das Granuloma trichophyticum Majocchi ist eine granulomatöse Follikel-assoziierte mykotische Entzündungsreaktion, verursacht durch einen Dermatophyten.
Ein Dermatophytid oder Mykid tritt als sogenannte Id-Reaktion beziehungsweise hypererge Reaktion auf Dermatophyten-Bestandteile infolge einer antimykotischen Behandlung einer ausgeprägten Tinea pedum oder anderen Dermatophytose auf.
Differenzialdiagnosen der Tinea faciei sind Impetigo contagiosa, atopisches Ekzem, Kontaktekzem, chronisch-diskoider Lupus erythematodes und Herpes zoster.
Die Mikrosporie ist ein früher gebräuchlicher Begriff für Infektionen des Gesichtes und der behaarten Kopfhaut durch Microsporum-Arten. Heute sollte besser von einer Tinea capitis oder Tinea corporis gesprochen werden, da Erreger sowohl Microsporum-, als auch Trichophyton-Arten sein können.
Die Tinea capitis ist die wichtigste und häufigste Dermatophyten-Infektion von Kindern zwischen 3 und 8 Jahren, häufig im 5. und 6. Lebensjahr.
In den USA ist “ anders als in Deutschland “ der anthropophile Dermatophyt Trichophyton tonsurans häufigster Erreger einer Tinea capitis.
Im Vergleich zu Kindern sind Erwachsene sehr selten von einer Tinea capitis betroffen.
In Nord- und Mittelamerika muss bei Tinea capitis vor allem mit Trichophyton tonsurans als Erreger gerechnet werden.
In Deutschland muss bei Tinea capitis im Erwachsenenalter infolge einer Autoinokulation vom eigenen Körper mit Trichophyton rubrum als Erreger gerechnet werden.
Bei Endothrix-Infektionen durch Trichophyton tonsurans, Trichophyton violaceum, Trichophyton soudanense und Trichophyton verrucosum sind (Arthro-)Sporen und Myzelien mikroskopisch im Inneren des Haarschaftes zu erkennen.
Bei der Ektothrix-Infektion durch Microsporum canis, Microsporum audouinii und Trichophyton interdigitale (zoophile Stämme) lagern sich Sporen und Pilzhyphen auଂen am Haarschaft an.
Zoophile Dermatophyten wie Microsporum canis und Trichophyton Spezies von Arthroderma benhamiae verursachen kreisrunde, erythematöse, hyperkeratotische, verkrustete, schuppende, zentrifugal wachsende und alopezische Formen der Tinea capitis.
Im Wood-Licht erkennt man Microsporum-canis-Infektionen an der grünlich-gelben Fluoreszenz.
Die “black dot”-Form der Tinea capitis entsteht als Restzustand der in Hautniveau abgebrochenen Haarschäfte bei Infektionen durch Trichophyton-Arten.
Das Kerion Celsi ist die Maximalvariante der Tinea capitis und stellt eine Abszess-artige tiefe Infektion der Kopfhaut dar.
Die Tinea capitis profunda tritt bei Infektionen durch zoophile Dermatophyten, beispielsweise Trichophyton. interdigitale oder Trichophyton verrucosum, aber auch bei Trichophyton Spezies von Arthroderma benhamiae auf.
Kinder können auch lediglich Träger (Carrier) eines Dermatophyten sein, insbesondere Trichophyton tonsurans und Microsporum audouinii sind auch asymptomatisch auf der Kopfhaut nachweisbar, beziehungsweise führen oft nur zu einer diskreten Pityriasis capillitii.
Bakterien sind bei Tinea capitis in der Regel lediglich Ausdruck einer sekundären Infektion.
Trichophyton tonsurans wird meist indirekt über kontaminierte Matten beim Kampfsport, beispielsweise Ringkampf, übertragen und ist für die “Tinea gladiatorum” verantwortlich.
Tinea unguium ist eine Onychomykose, die durch einen Dermatophyten verursacht wird, meist durch Trichophyton rubrum.
Die Onychomykose ist eine Nagelpilzinfektion, welche durch Dermatophyten, Hefe- oder Schimmelpilze verursacht sein kann.
Die distale und laterale subunguale Onychomykose beginnt am distalen, freien Rand der Zehennägel.
Yellow streaks entsprechen den sogenannten Dermatophytomen und weisen auf eine Matrixbeteiligung der Onychomykose hin.
Die proximal subunguale Onychomykose kann ein Zeichen für eine Immunsuppression des betroffenen Patienten sein, man sieht sie in Afrika, aber auch in Deutschland, bei HIV-Positiven sowie AIDS-Kranken.
Die weiଂe superfizielle Onychomykose entwickelt sich bei oberflächlichem Befall der Nagelplatte mit Trichophyton rubrum oder Trichophyton interdigitale.
Bei der endonychialen Onychomykose fehlt die subunguale Hyperkeratose, es tritt keine Onycholyse auf.
Hyperkeratotisch verdickte und weiଂ gefärbte Nägel sind typisch für die endonychiale Onychomykose.
Die Maximalvariante der Onychomykose ist die totale dystrophische Onychomykose.
Die Onychia et Paronychia candidosa wird durch Hefepilze verursacht und entwickelt sich oft infolge einer bakteriellen Paronychie.
Die Onychomykose im Kindesalter scheint zuzunehmen.
Candidosen der Mundschleimhaut (Soor) betreffen in der Regel immunsupprimierte Patienten.
Auch lokale Faktoren “ beispielsweise Zahnprothesen bei älteren Menschen “ begünstigen eine Schleimhautinfektion durch Candida albicans.
Bei chronisch-atrophischer oraler Candidose sind Zunge und Mundschleimhaut hochrot.
Die hyperplastische Schleimhautinfektion entspricht der rhomboidalen Glossitis oder Glossitis rhombica mediana (engl.: midline glossitis).
Die pseudomembranöse Candidose der Zunge entspricht dem “Soor”.
PerlËche oder Angulus infectiosus treten typischerweise bei Zahnprothesenträgern auf.
Candidosen der Haut betreffen überwiegend die intertriginösen Areale (Leisten, submammäre Haut, Finger- und Zehenzwischenräume.
Pusteln und Collerette-artige (Halskrausen-artige) Schuppung sind Zeichen einer kutanen Candidose.
Eine Sonderform der kutanen Candidose ist die Windeldermatitis mit Mazeration infolge des feucht-warmen Milieus, Erosion und Schuppung.
Die Folliculitis barbae candidomycetica sollte mikrobiologisch von einer bakteriellen Follikulitis oder einer Tinea barbae durch Dermatophyten unterschieden werden.
Prädilektionsstellen für das Auftreten der Pityriasis versicolor sind vordere und hintere Schweiଂrinne, Brust, DekolletÈ, Schultern und Oberarme.
Typisch für die Pityriasis versicolor sind makulöse, hypo- und hyperpigmentierte Läsionen, bei denen eine diskrete, kleieförmige Schuppung auslösbar ist.
Die Pityriasis versicolor betrifft bei Europäern niemals das Gesicht.
Eine Regel besagt, dass bei einem positiven Nativpräparat topisch antimykotisch behandelt werden kann, erst nach kultureller Sicherung kann die systemische antimykotische Therapie begonnen werden.
Zur Diagnostik einer Tinea capitis durch anthropophile Dermatophyten (Trichophyton tonsurans) ist die Haarbürstenmethode dem Abschaben von Kopfschuppen signifikant überlegen.
Die konventionelle Diagnostik mittels Kalilaugenpräparat weist “ insbesondere bei der Onychomykose “ eine ungenügende diagnostische Empfindlichkeit auf.
Die fluoreszenzoptischen Präparate Blankophor® oder Calcofluor® sind die empfindlichsten mikroskopischen Untersuchungsverfahren zum Nachweis einer Dermatomykose.
Zum kulturellen Pilznachweis sollten von jeder Materialprobe zwei Nährböden beimpft werden, einer davon enthält Cycloheximid (Actidion®) zur Unterdrückung des Schimmelpilzwachstums.
Der kulturelle Ansatz erfolgt bei 26”32 ∞C, am besten bei 28 ∞C, über drei (bis vier) Wochen.
Der kulturelle Pilznachweis versagt relativ häufig, Ursache dafür ist meist die Vorbehandlung mit einem topischen oder systemischen Antimykotikum.
Der histologische Nachweis von Pilzen bei Nagelpilzinfektionen weist eine sehr hohe Empfindlichkeit auf.
Die Spezifität der Histologie ist jedoch gering, da aufgrund der Morphologie der im Gewebe erkennbaren Hyphen und Sporen nicht auf die Pilzgattung oder -art geschlossen werden kann.
Inwieweit histologisch vom Pathologen beschriebene “PAS-positive” Pilzelemente tatsächlich der Beweis für eine Onychomykose sind, muss vom Dermatologen kritisch auf Plausibilität hinterfragt werden, insbesondere kann es sich auch um sekundäres mykotisches Wachstum handeln.
Neue molekulare Methoden können die “diagnostische Lücke”, welche Präparat und Kultur lassen, schlieଂen und die Empfindlichkeit sowie Spezifität der mykologischen Diagnostik erhöhen.
Zum Direktnachweis von Dermatophyten in Hautschuppen und Nagelmaterial stehen heute als Nukleinsäureamplifikationstechniken Polymerasekettenreaktionen (polymerase chain reaction; PCR) zur Verfügung.
Die PCR auf Dermatophyten erhöht den Anteil positiver Ergebnisse, die Zeit bis zur Diagnosestellung wird verkürzt (24-Stunden-Diagnostik). Die Methode ist wirtschaftlich, lediglich der Personalaufwand ist hoch.
Mittelfristig wird die konventionelle dermatomykologische Diagnostik durch molekulare Methoden er-gänzt werden.
Die MALDI-TOF (matrix-assisted laser desorption ionization-time of flight)-Massenspektrometrie (MS) ist als Kulturbestätigungstest zur Differenzierung von Fadenpilzen, auch Dermatophyten, mittlerweile in gröଂeren Laboren etabliert.
Zusammenfassung
Pilzinfektionen der Haut werden in Deutschland und weltweit am häufigsten durch Dermatophyten verursacht. Die Tinea pedis ist die häufigste Pilzinfektion in den Industriestaaten der westlichen Welt. Ausgehend von dieser Dermatophytose entwickelt sich eine Tinea unguium. Insbesondere bei älteren Patienten kommt es infolge Autoinokulation von der Tinea pedis et unguium zu Tinea-Formen der freien Haut. Die Tinea capitis tritt bei Erwachsenen selten auf. Dagegen gilt sie als häufigste Pilzinfektion im Kindesalter. Bei der antimykotischen Behandlung der Tinea unguium und der Tinea capitis kann ein Dermatophytid auftreten.
Hefepilzinfektionen betreffen die Schleimhaut von Orointestinaltrakt und Genitalsystem. Die Candidose der Haut betrifft vorzugsweise die intertriginösen Regionen der Hautfalten. Dagegen ist die Pityriasis versicolor eine oberflächliche Pilzinfektion am Körperstamm. Schimmelpilzinfektionen sind selten und spielen fast nur bei der Onychomykose eine Rolle.
Die Diagnostik von Dermatomykosen umfasst den mikroskopischen Pilznachweis mittels Kaliumhydroxid- bzw. alternativ fluoreszenzoptischem Blankophor-Präparat und den kulturellen Pilznachweis. Dem histologischen Pilznachweis mittels PAS-Färbung sollte aufgrund der hohen Empfindlichkeit insbesondere bei der Onychomykose-Diagnostik ein wesentlich höherer Stellenwert zukommen. Mit der PCR, u. a. einem Dermatophyten-PCR-ELISA, lassen sich die Erreger direkt im klinischen Material spezifisch und hoch empfindlich nachweisen. Molekulare Methoden, auch die MALDI-TOF (matrix-assisted laser desorption ionization-time of flight)-Massenspektrometrie (MS) als Kulturbestätigungstest, ergänzen die konventionelle mykologische Diagnostik.
Einleitung
Dermatomykosen sind Infektionen der Haut, der Nägel und der Haare durch Dermatophyten, seltener durch Hefepilze, und nur gelegentlich, vor allem mit Blick auf die Zehennägel, auch durch Schimmelpilze. Dermatophyten sind die Ursache von Dermatophytosen oder der Tinea. Die Tinea pedis gilt als häufigste Pilzinfektion, gefolgt von der Tinea unguium und der Tinea corporis. Ein und dasselbe klinische Erscheinungsbild an Haut und Nägeln kann durch verschiedene Erreger, d. h. Dermatophyten-Arten, verursacht werden. Aufschluss darüber gibt letztlich nur die sachgerecht durchgeführte mykologische Diagnostik. Seltene klinische Erscheinungsformen sind Tinea faciei und Tinea capitis, aber auch die Tinea cruris. Insbesondere die Tinea capitis ist eine wieder sehr aktuelle Infektion bei Kindern und Jugendlichen. Die oft eitrig-abszedierenden, tiefen Haarwurzelinfektionen (Kerion Celsi), aber auch hartnäckige hyperkeratotische Formen der Tinea capitis, sind die ureigene Domäne der dermatologischen Diagnostik und Therapie.
Der Begriff der Tinea incognito, manchmal auch als Tinea atypica bezeichnet, wird neuerdings mehr und mehr beansprucht. Hintergrund ist die Erfahrung, dass Dermatomykosen, insbesondere Dermatophytosen, primär nicht als solche erkannt werden. Die antientzündliche oder antibakterielle Therapie zeigt keinen Effekt, so dass erst im Nachhinein an eine Mykose gedacht und eine mykologische Diagnostik durchgeführt wird. Die Differenzialdiagosen der Dermatomykosen an Haut und Nägeln sind vielfältig. Neben der Psoriasis vulgaris mit ihren Sonderformen Psoriasis inversa und Psoriasis unguium sind eine Reihe weiterer entzündlicher Dermatosen zu bedenken.
Abzugrenzen von den Dermatophytosen der Haut und Nägel sind Hefepilzinfektionen, meist durch Candida-Arten. Diese betreffen mehr die intertriginösen Hautareale, neben den großen Körperfalten sind das auch die Interdigital-Räume der Finger und Zehen. Die Pityriasis versicolor oder „Kleie-Flechte“ ist die wichtigste und häufigste Malassezia-assoziierte oberflächliche Hautinfektion.
Die moderne mykologische Diagnostik umfasst heute neben den klassischen Bestandteilen Nativpräparat und Pilzkultur auch molekularbiologische Methoden. Letztere werden zunehmend in Laboren, neuerdings auch in Hautarztpraxen, eingesetzt. Die mikroskopische Diagnostik mit dem Kalilaugen-Präparat sollte heute durch das empfindlichere fluoreszenzoptische Präparat Calcofluor® oder Blankophor® ergänzt, vielleicht sogar ersetzt werden. Die Pilzkultur – der „Goldstandard“ der mykologischen Diagnostik – ist nach wie vor langwierig, das Ergebnis liegt erst nach zwei bis vier Wochen vor. Nur bei zoophilen Dermatophyten ist das Pilzwachstum bereits nach wenigen Tagen erkennbar. Zur molekularbiologischen Diagnostik sind Nukleinsäure-Amplifikationstechniken für den Einsatz in der Dermatomykologie etabliert. Es handelt sich fast immer um eine Polymerasekettenreaktion (polymerase chain reaction, PCR) zum Direktnachweis von Dermatophyten-DNA aus Hautschuppen, Nagelspänen und Haarwurzeln sowie aus Hautabstrichen. Nachteil der molekularbiologischen Methoden ist der hohe apparative und personelle Aufwand, der Vorteil ist die im Vergleich zur Pilzkultur deutlich höhere Empfindlichkeit und vor allem die Zeitersparnis. Das Ergebnis des molekularbiologischen Pilznachweises bis zur Spezies-Ebene liegt im günstigsten Fall bereits nach 24 Stunden vor.
Klinisches Bild der Dermatomykosen
Dermatophytosen
Tinea pedis
Die Tinea pedis beginnt als Tinea interdigitalis meist im Zehenzwischenraum mit hyperkeratotischen, trockenen, schuppenden und später mazerierten, nässenden und erosiven Läsionen. Das klinische Bild ist nicht erregerspezifisch, d. h. verschiedene Dermatophyten-Arten können der Tinea pedis, aber auch jeder anderen Tinea-Form zugrunde liegen. Das Erregerreservoir für die Tinea pedis stellen anthropophile Dermatophyten, neben Trichophyton (T.) rubrum auch T. interdigitale (anthropophile Stämme) und Epidermophyton floccosum, dar. Die interdigitale Tinea pedis ähnelt der wenig bekannten Psoriasis alba oder interdigitalen Psoriasis . Unterscheidungskriterium ist die negative mykologische Diagnostik. Juckreiz ist bei Tinea pedis mäßig ausgeprägt, im Verlauf kommt es durch Rhagadenbildung zu Brennen und Schmerzen. Sekundäre bakterielle Infektionen mit grampositiven (Staphylococcus aureus, A-Streptokokken) und gramnegativen (Escherichia coli, Klebsiella spp., Pseudomonas aeruginosa, Proteus spp.) Erregern führen zur Mazeration und zum Foetor. Differenzialdiagnostisch ist ein (interdigitales) Erythrasma durch Corynebacterium minutissimum auszuschließen, außerdem eine Candidosis interdigitalis bei immunsupprimierten Patienten.
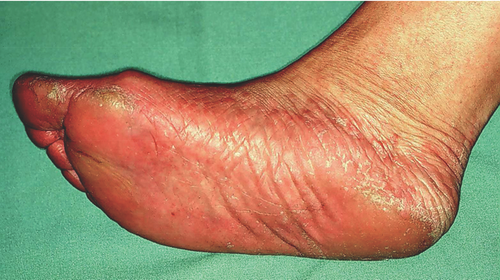
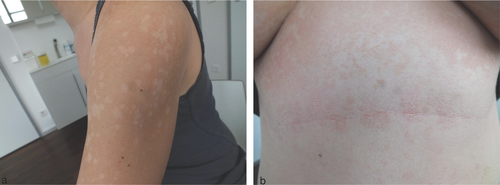
Beim hyperkeratotischen Typ der Tinea pedis breitet sich die Infektion plantar, medial und lateral auf Fußkanten und Fußrücken aus. Diese sogenannte Mokassin-Form der Tinea pedis ist klinisch kaum von einem atopischen Fußekzem oder einer Psoriasis plantaris zu unterscheiden (Abbildung ). Eine weitere Differenzialdiagnose ist das Keratoma sulcatum oder pitted keratolysis infolge Mazeration bei Hyperhidrosis plantaris und starker Besiedlung durch Corynebacterium spp. und Kytococcus sedentarius sowie Dermophilus congolensis. Eine seltene Differenzialdiagnose ist die autosomal-rezessiv vererbte Palmoplantarkeratose vom Typ Gamborg-Nielsen, die zudem gelegentlich sekundär mykotisch mit T. rubrum infiziert sein kann .
Der dritte Typ ist die entzündliche vesikulobullöse oder dyshidrotische Tinea pedis entweder plantar im Fußgewölbe oder medial an der Fußkante (Abbildung a, b). In klassischer Weise treten oberflächliche, juckende Bläschen auf entzündlich gerötetem Grund auf, es kommt zu Exfoliationen des Stratum corneum mit Schuppung.
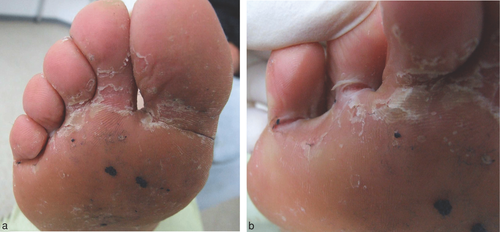
Dyshidrosiformes Fußekzem, Kontaktekzeme und Impetigo contagiosa sind auszuschließen. Differenzialdiagnostisch ist außerdem an die juvenile plantare Dermatose sive Dermatitis plantaris sicca (entspricht der atopischen Dermatitis im Bereich der Fußsohle) zu denken. Gewissheit bringt auch hier die mykologische Untersuchung. Es gibt Überschneidungen zur Keratolysis exfoliativa (Dyshidrosis lamellosa sicca), die neuerdings als eigenständige Entität angesehen wird . Es handelt sich dabei wahrscheinlich weder um ein dyshidrosiformes Ekzem noch um eine Pilzinfektion oder eine Id-Reaktion im Sinne eines Dermatophytids. Eine unvollständige bzw. unreife Corneodesmolyse wird heute als der hauptsächliche Pathomechanismus dieser palmoplantaren Dermatose angesehen.
Tinea corporis
Dermatophytosen imponieren an der freien Haut als zentrifugal wachsende, erythrosquamöse schuppende Plaques. Tinea corporis und Tinea capitis werden deshalb im Englischen als ringworm bezeichnet. Eine ältere deutsche Bezeichnung ist „Ringelflechte“, auch für die Tinea capitis. Eine Sonderform der Tinea corporis stellt aufgrund der besonderen ringförmigen Morphologie die Tinea circinata dar, ursächlich ist oft T. tonsurans, manchmal auch Microsporum (M.) gypseum. Schwer davon abzugrenzen ist die vorzugsweise in Südostasien (Vietnam, Polynesien), aber auch in Afrika und Süd-Amerika auftretende Tinea imbricata (Tokelau) durch das langsam wachsende T. concentricum.
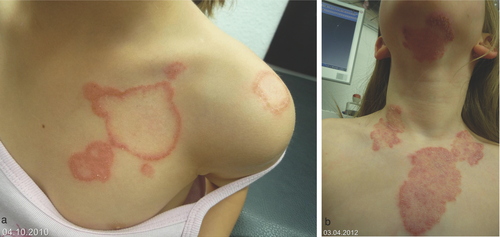
Ursache der Tinea corporis bei Erwachsenen ist überwiegend T. rubrum, gelegentlich auch T. interdigitale. Differenzialdiagnostisch sind Psoriasis vulgaris, Impetigo contagiosa, atopisches Ekzem, Kontaktekzem, Erythema multiforme, aber auch das Granuloma anulare zu bedenken. Bei Kindern und Jugendlichen stellen zoophile Dermatophyten die wesentliche Ursache einer Tinea corporis dar (Abbildung a, b). Infektionsquelle sind im häuslichen Milieu gehaltene kleine Felltiere, welche entweder an einer Dermatophytose leiden, oder die lediglich asymptomatische Träger eines zoophilen Dermatophyten sind. In den USA, Lateinamerika (Mexiko), aber auch in Großbritannien wird als zweithäufigster Erreger einer Tinea corporis nach T. rubrum das anthropophile T. tonsurans nachgewiesen . In Afrika spielen T. violaceum und M. audouinii die entscheidende Rolle.
Tinea inguinalis und Tinea glutealis
Die Tinea inguinalis ist meist Folge einer Autoinokulation bei bestehender Tinea pedis et unguium. Erreger ist häufig T. rubrum, aber auch T. interdigitale und Epidermophyton floccosum können im Leistenbereich isoliert werden. Frauen haben offenbar sehr selten eine Tinea inguinalis, fast immer sind Männer betroffen. Im Einzelfall wird jedoch auch bei „Intertrigo“ der Leistenregion der Frau ein Dermatophyt als ursächliches Pathogen isoliert.
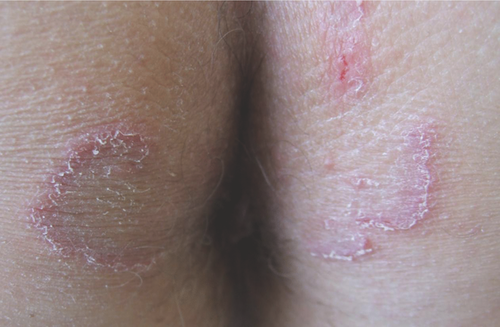
Klinisches Erscheinungsbild der Tinea inguinalis ist aufgrund der Randbetonung der schuppenden, auch mazerierten Läsionen das erstmals 1860 vom Begründer der Wiener Dermatologenschule Ferdinand Ritter von Hebra (1816–1880) so bezeichnete „Eczema marginatum (Hebra)“. Die Tinea glutealis wird häufig als Analekzem angesehen und als Mykose verkannt (Abbildung ). Erythematosquamöse und randbetonte Plaques werden bei einem Teil der Patienten mit Tinea glutealis durch follikulär-entzündliche Papulopusteln komplettiert.
Tinea cruris
Die Tinea cruris gilt als seltene Form einer Dermatophytose. Differenzialdiagnosen sind Psoriasis vulgaris, mikrobielles Ekzem, Stauungsekzem und Kontaktekzem. Eine Sonderform ist die Tinea granulomatosa follicularis et nodularis cruris bei Frauen infolge der Rasur der Unterschenkel. Am Rande erwähnt sei, dass Tinea cruris im angloamerikanischen Sprachraum oft fälschlicherweise für die Tinea inguinalis steht.
Tinea incognito
Die Tinea incognito, neuerdings auch als Tinea atypica bezeichnet, zeigt viele Überlappungen zum T.-rubrum-Syndrom . Bei Tinea incognito, der nicht erkannten Tinea, wird nicht an eine Dermatophytose der Haut gedacht. Diverse infektiöse und entzündliche Dermatosen werden differenzialdiagnostisch in Betracht gezogen und es erfolgt fälschlicherweise eine antientzündliche Behandlung mit topischen Glukokortikoiden. Weltweit wird eine Zunahme des Tinea incognito verzeichnet. Das ist einerseits damit zu erklären, dass es tatsächlich immer mehr Patienten gibt, die disponiert sind für eine ausgeprägte Tinea corporis, andererseits muss durchaus kritisch vermerkt werden, dass bei Verzicht auf eine zielführende mykologische Diagnostik eine Dermatomykose von vornherein differenzialdiagnostisch überhaupt nicht berücksichtigt wird.
Seitz et al. beschrieben aktuell vier Patienten mit ausgeprägter Tinea corporis, die anfänglich nicht als solche erkannt worden ist. Die Tinea wurde als kutanes T-Zell-Lymphom oder bullöses Pemphigoid angesehen bzw. sie erhielten eine für eine Dermatophyten-Infektion disponierende Therapie (Steroide oder Azathioprin).
Per definitionem ist die Tinea incognito eine Dermatophyten-Infektion, bei der infolge einer ungerechtfertigten Anwendung von topischen Glukokortikoiden oder Calcineurin-Inhibitoren das typische klinische Erscheinungsbild verloren gegangen ist . Von 283 Patienten mit Tinea incognito in Korea war mehr als die Hälfte (59 %) vorab von Nicht-Dermatologen bzw. in Selbstmedikation behandelt worden. Bezeichnend war die durchschnittliche Dauer der Tinea incognito von 15 ± 25 Monaten. Das klinische Erscheinungsbild ließ primär an Ekzem- und Psoriasis-artige Dermatosen sowie an einen Lupus erythematodes denken. Betroffen waren häufig der Körperstamm und das Gesicht. Unter 67 isolierten Pilz-Stämmen war T. rubrum mit 73 % am häufigsten. Bei therapierefraktären ekzemartigen Dermatosen am Körperstamm oder im Gesicht, die gleichzeitig mit einer Tinea pedis bzw. Tinea unguium auftreten, sollte an eine Tinea incognito gedacht werden.
Bei einer 55-jährigen Japanerin wurden pruritische und erythematöse sowie erosive Läsionen im Gesicht und Nacken klinisch als ein Pemphigus erythematosus angesehen . Die direkte und indirekte Immunfluoreszenz (Anti-Desmoglein-1- und -3-Antikörper) war jedoch unauffällig. Erst die mykologische Untersuchung von Hautschuppen erbrachte die Diagnose einer Tinea faciei et corporis incognito. Der Erreger war hier überraschenderweise M. canis.
Trichophyton rubrum-Syndrom
Das Trichophyton (T.)-rubrum-Syndrom ist eine chronisch verlaufende generalisierte Dermatophytose. Die älteren Bezeichnungen chronisches Dermatophytosesyndrom, generalisierte, chronisch-persistierende Rubrophytie, aber auch Tinea corporis generalisata oder im Englischen “dry-type”-T. rubrum infection meinen letztlich dieselbe Entität einer Dermatomykose. Beim T.-rubrum-Syndrom sind mindestens vier Lokalisationen des Körpers betroffen, die Füße (plantar), Hände (palmar), Nägel sowie eine weitere Lokalisation am Integument. Die Inguinalregion als sonst häufige Lokalisation einer Tinea ist explizit ausgeschlossen. Zweites Kriterium für die Diagnosestellung T.-rubrum-Syndrom ist der mikroskopische Pilznachweis (KOH oder Blankophor®), ebenfalls von allen vier Lokalisationen. Das dritte Kriterium, der kulturelle Nachweis von T. rubrum aus mindestens drei der vier Lokalisationen der Tinea ergibt sich selbstverständlich (Abbildung a, b).
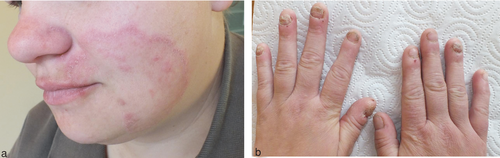
Nach wie vor nicht geklärt ist, ob es sich beim T.-rubrum-Syndrom um eine eigenständige nosologische Entität handelt. Als disponierender Faktor muss zudem eine zuvor erfolgte lokale oder auch systemische Steroidbehandlung angesehen werden. Piñeiro et al. wiesen auf die sekundäre Tinea infolge einer Autoinokulation von einer Primärinfektion der Füße hin, bei 7 % dieser sekundären Infektionen würde ein T.-rubrum-Syndrom vorliegen. Vier 38 bis 56 Jahre alte männliche Patienten mit T.-rubrum-Syndrom wiesen disponierende Faktoren auf. Sie hatten entweder ein Down-Syndrom, eine HIV-Infektion, Diabetes mellitus oder erhielten eine topische Kortikosteroid-Therapie. Ein Morbus Cushing mit endogenem Hyperkortisolismus muss ebenfalls als disponierender Faktor für eine chronische und therapierefraktäre Dermatophytose durch T. rubrum angesehen werden .
Tinea manus
Der Befall der Hände mit Dermatophyten ist selten. Klinisch imponiert diese Tinea-Form mit schuppenden, hyperkeratotischen, sich zentrifugal ausbreitenden erythrosquamösen Hautveränderungen (Abbildung ). Differenzialdiagnosen sind Psoriasis palmaris, atopisches Handekzem und Kontaktekzeme unterschiedlicher Genese auszuschließen. Häufigster Erreger ist T. rubrum. Die Infektion entsteht, wie oben beschrieben, infolge einer Autoinokulation von infektiösem Haut- und Nagelmaterial bei Tinea pedis et unguium.
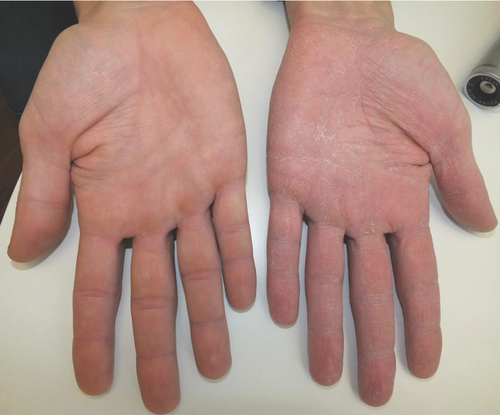
Bullöse Tinea
Selten tritt die Tinea in der bullösen Form auf, z. B. auch bei Tinea manus . Erreger ist oftmals T. rubrum, im Einzelfall sind auch zoophile Dermatophyten ursächlich, z. B. Trichophyton Spezies von Arthroderma benhamiae. Morphologisch sieht man Blasenbildung – manchmal mit trüb-serösem Inhalt – auf den erythrosquamösen Plaques, oft im Randbereich, so dass differenzialdiagnostisch an Impetigo contagiosa, Herpes simplex der Haut, aber auch blasenbildende Dermatosen gedacht wird. Die Probeexzision mit Nachweis von septierten Pilzhyphen in der PAS-Färbung bringt Aufklärung. Gelegentlich ist bei bullöser Tinea eine Probeexzision auch nicht unbedingt erforderlich, sondern es reicht eine histologische Untersuchung des Blasendachs. Einfacher wäre eine frühzeitig durchgeführte mykologische Untersuchung von Hautschuppen oder ein Abstrich auf Dermatophyten.
„One-Hand/Two-Feet-Mykose“
Bei einer Pilzinfektion nur einer – meist der linken – Hand (Palmae) zusammen mit adäquaten Hauterscheinungen an beiden Füßen (plantare und interdigitale Mykose), oft unter Einbeziehung der Finger- und Zehennägel, kann aufgrund des klinischen Bildes die Verdachtsdiagnose der „One-Hand/Two-Feet-Mykose“ (OHTFM) oder auch two-feet-one-hand-syndrome gestellt werden . Erreger dieser Tinea manus et pedum et unguium ist meist T. rubrum, gelegentlich auch T. interdigitale.
Differenzialdiagnosen sind dyshidrosiformes Hand- und Fußekzem, kumulativ-subtoxisches, evtl. allergisches Kontaktekzem sowie Psoriasis palmoplantaris.
Die OHTFM betrifft häufiger Männer. Ursache ist die Übertragung des Dermatophyten von der Tinea pedis oder Onychomykose auf die (linke) Hand, beispielsweise beim Kratzen. Im Einzelfall ist die rechte Hand betroffen, als Tinea manus oder Tinea unguium. Es besteht zudem eine Korrelation zur Pediküre, bei der die rechte Hand die Schere hält, die linke Hand dagegen Kontakt zur mykotisch befallenen Haut und den Nägeln an den Füßen hat. Bei 113 Patienten mit bilateraler Tinea pedis und unilateraler Tinea manuum in China bestand ein signifikanter Zusammenhang zwischen Tinea manus und der Hand, mit welcher an den Füßen gekratzt wurde . Die Genotypisierung mit PCR-Amplifikation der tandem repeat elements der ribosomalen DNS der nontranscribed spacer region der Isolate zeigte, dass 94,5 % der Paare von Hand und Füßen zur selben Spezies (T. rubrum) gehörten, 80 % der Paare hatten den selben Genotyp.
Die kontralaterale Hand ist nicht infiziert bzw. weist keine Zeichen einer Tinea manus auf. Ein subklinischer Befall durch den Dermatophyten ist jedoch möglich. Spekuliert wird über eine disponierende Hyperhidrosis manuum mit Links-Rechts-Asymmetrie. Außerdem ist meist die nichtdominierende (linke) Hand betroffen. Dagegen verfügt die dominierende oder Arbeitshand über ein stärker ausgeprägtes, schützendes Stratum corneum.
Granuloma trichophyticum Majocchi
Das Granuloma trichophyticum ist eine primär chronisch verlaufende intrakutan-subkutane Dermatophytose. Beschrieben wurde diese Form einer Dermatophyten-Infektion erstmals 1883 vom italienischen Dermatologen Domenico Majocchi (1849–1929) . Die juckenden und schuppenden erythrosquamösen Plaques weisen follikulär gebundene Papeln und Pusteln auf. Infolge einer oberflächlichen Dermatophytose kommt es durch Infiltration der Pilzmyzelien in die Tiefe entlang der Haarfollikel zur Ruptur derselben. Daraus entwickelt sich eine granulomatöse Follikel-assoziierte Entzündungsreaktion. Betroffen sind insbesondere immunsupprimierte Patienten, z. B. nach Herztransplantation . Erreger eines Majocchi-Granuloms ist meist T. rubrum. Andere Dermatophyten können ebenfalls ursächlich sein, z. B. T. tonsurans als Erreger einer Tinea corporis gladiatorum unter dem klinischen Bild eines Majocchi-Granuloms .
Ein Patient mit rheumatoider Arthritis, welcher mit Methotrexat und Prednisolon behandelt wurde, entwickelte innen am Oberschenkel stark juckende follikulär gebundene Papeln und Knoten. Histologisch fanden sich in der mittleren und tiefen Dermis periadnexiell gemischtzellige Infiltrate aus Histiozyten, neutrophilen Granulozyten und Lymphozyten sowie Nachweis von Pilzelementen im Bereich der Haarschäfte in der PAS-Färbung (kulturell T. rubrum). Es wurde die Diagnose einer nodulären granulomatösen Perifollikulitis durch T. rubrum (Granuloma trichophyticum) gestellt .
Dermatophytid
Ein Dermatophytid oder Mykid tritt als sogenannte Id-Reaktion wahrscheinlich häufiger als vermutet auf . Es handelt sich dabei um eine hypererge Reaktion auf Dermatophyten-Bestandteile infolge einer antimykotischen Behandlung einer ausgeprägten Tinea pedum. Prinzipiell kann ein Dermatophytid auch bei jeder anderen Tinea-Form auftreten . Gerade beschrieben wurde ein Dermatophytid bei einem 8-jährigen Jungen mit Tinea capitis . Die Id-Reaktion tritt als symmetrische dyshidrosiforme Eruption an Händen und Füßen oder als nodöse und multiforme Eruptionen in Erscheinung, vorzugsweise an den Extremitäten. Dieser Ausschlag wird oft als Arzneimittelreaktion oder Intoleranzreaktion auf das Antimykotikum fehlgedeutet. Auch bei weiterer Gabe der Antimykotika blassen diese Dermatophytide ab, sind also kein Ausdruck einer Arzneimittelintoleranz . Im konkreten Fall ist die Entscheidung über die Fortführung der Behandlung jedoch schwierig.
Tinea faciei
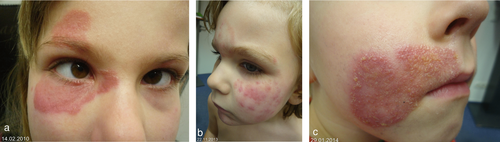
Im Gesicht, oft an den Wangen, auch an den Augenlidern, manchmal submandibulär, entwickeln sich erythematöse, randbetonte, zentrifugal wachsende Herde mit diskreter Schuppung (Abbildung a–c). Deshalb sollte bei (schwach oder nicht) juckenden, schuppenden, randbetonten Herden im Gesicht immer auch eine Tinea faciei durch mykologische Diagnostik ausgeschlossen werden. Differenzialdiagnostisch in Frage kommende Dermatosen sind u. a. Impetigo contagiosa, atopisches Ekzem, Kontaktekzem, chronisch-diskoider Lupus erythematodes und Herpes zoster (Tabelle ). Bei Kindern stehen zoophile Dermatophyten – zoophile Stämme von T. interdigitale, außerdem M. canis und Trichophyton Spezies von Arthroderma benhamiae – als Ursache einer Tinea faciei im Vordergrund.
Tabelle 1. Differenzialdiagnosen der Tinea faciei
| ▸ (allergische) Kontaktdermatitis |
| ▸ atopisches Ekzem |
| ▸ diskoider Lupus erythematodes |
| ▸ Granuloma faciale |
| ▸ Herpes zoster |
| ▸ Impetigo contagiosa |
| ▸ Lyme-Borreliose (Erythema migrans, Lymphozytom) |
| ▸ lymphozytische Infiltration der Haut |
| ▸ periorale Dermatitis |
| ▸ polymorphe Lichtdermatose |
| ▸ Psoriasis vulgaris |
| ▸ Rosazea |
| ▸ Sarkoidose der Gesichtshaut |
| ▸ „Schmetterlingserythem“ bei systemischem Lupus erythematodes |
| ▸ seborrhoisches Ekzem |
Tinea capitis
Die „Tinea“ (lat. Holzwurm oder Motte) ist der historisch entstandene Begriff für eine Dermatophyten-Infektion des behaarten Kopfes, die zu einem von „Motten zerfressenen“ Aussehen der Kopfhaut führt. Der früher gebräuchliche Begriff der Mikrosporie meinte Infektionen im Gesicht und auf der behaarten Kopfhaut durch Microsporum-Arten, in den 50er Jahren des letzten Jahrhunderts meist M. audouinii, aber auch M. canis und M. gypseum. Schon damals, 1969, kamen Braun-Falco und Meinhof zu dem Schluss, dass Dermatophytosen nicht nach dem Erreger – also Mikrosporie durch Microsporum-Arten – bezeichnet werden sollten. Dasselbe trifft zu auf den alten Begriff Trichophytia profunda capillitii. Die Morphologie der jeweiligen Tinea-Form lässt auch bei der Tinea capitis keinen Rückschluss auf die verursachende Dermatophyten-Spezies zu.
Die Tinea capitis ist die wichtigste Dermatophyten-Infektion von Kindern zwischen 3 und 8 Jahren, häufig im 5. und 6. Lebensjahr. Jungen galten früher als bevorzugt befallen, insbesondere mit Blick auf M.-canis-Infektionen . Diese Geschlechtsprädisposition wird jedoch heute – auch in den USA – nicht mehr gesehen, es besteht eine ausgewogene Verteilung zwischen Mädchen und Knaben .
In Deutschland werden die gleichen zoophilen Dermatophyten, wie sie für die Tinea corporis und Tinea faciei verantwortlich sind, auch bei Tinea capitis isoliert. In den USA findet man – anders als in Deutschland – den anthropophilen Dermatophyten T. tonsurans als häufigsten Erreger der Tinea capitis. In Afrika südlich der Sahara (Sub-Saharan-Africa) ist mit einer besonders hohen Prävalenz von Dermatophytosen (Tinea corporis und Tinea capitis) unter Kindern vor allem im Schulalter zu rechnen. In Gondar, Äthiopien, hatten 47,5 % von 372 Schülern in einer ländlichen Region klinische Zeichen einer Tinea capitis . Hauptsächlicher Erreger war T. violaceum, gefolgt von T. verrucosum. Eine aktuelle Studie aus Tunesien weist ebenfalls T. violaceum als häufigste Ursache der Tinea capitis aus, gefolgt von M. canis, Trichophyton-interdigitale-Komplex und T. verrucosum.
M. audouinii als anthropophiler Pilz wird in Frankreich wieder vermehrt gefunden, vor allem in Immigrantenfamilien aus afrikanischen Ländern . Aktuell kam es in München, Berlin, Hannover und Wittlich (Rheinland-Pfalz) zu Ausbrüchen von M.-audouinii-Infektionen bei Kindern von Immigranten aus Afrika.
Geophile Dermatophyten verursachen selten eine Tinea capitis. Hauptsächlicher Vertreter in dieser Gruppe ist M. gypseum. Diese Pilze gelangen durch Kontakt zu Erde und Staub vom Boden, z. B. beim Spielen im Freien, auf die Haut an den Händen und gelegentlich auf die Kopfhaut.
Tinea capitis bei Erwachsenen
Im Vergleich zu Kindern sind Erwachsene sehr selten von einer Tinea capitis betroffen . Da das klinische Bild meist nicht typisch ist, wird oft zunächst in eine andere Richtung gedacht und antientzündlich mit topischen Glukokortikoiden behandelt. Die in Frage kommenden Differenzialdiagnosen sind in Tabelle aufgeführt. Eine ungewöhnliche Infektion ist ein Favus durch T. schoenleinii bei einer 34-jährigen, aus dem Kosovo stammenden Patientin in Würzburg . Hier war aufgrund der unspezifischen Symptome Schuppung, Erythem, kreisrunder Haarausfall mit Verlust der Haarfollikel zunächst an einen Lichen ruber gedacht und topisch mit Clobetasolpropionat behandelt worden. Erst die Histologie hat mit dem Nachweis von Sporen und Pilzhyphen eine Tinea capitis ergeben. Die Trichoskopie zeigt gelegentlich sogenannte Korkenzieher-Haare bei Tinea capitis des Erwachsenen .
Tabelle 2. Differenzialdiagnosen der Tinea capitis
| ▸ Alopecia areata |
| ▸ bakterieller Abszess der behaarten Kopfhaut |
| ▸ diskoider Lupus erythematodes |
| ▸ erosive pustulöse Dermatitis des Kapillitium |
| ▸ Folliculitis decalvans |
| ▸ Folliculitis et Perifolliculitis capitis abscedens et suffodiens (Hoffmann) |
| ▸ hyperkeratotische aktinische Keratosen |
| ▸ Folliculitis sclerotisans nuchae |
| ▸ Impetigo contagiosa |
| ▸ Lichen planopilaris (Lassueur-Graham-Little-Syndrom) |
| ▸ Pyodermien: Furunkel/Karbunkel |
| ▸ seborrhoisches Ekzem der Kopfhaut |
| ▸ Pityriasis amiantacea (alt: Tinea amiantacea) |
| ▸ Pityriasis capillitii |
| ▸ Psoriasis capitis |
| ▸ sterile eosinophile Pustulose Ofuji |
| ▸ Syphilis II (Alopecia specifica syphilitica als DD der “Mottenfraß”-artigen Tinea) |
| ▸ Trichotillomanie |
| ▸ vernarbende Alopezie |
Aus Kalifornien stammt eine Patientenbeschreibung sowie Literaturübersicht zur Tinea capitis, die primär als Folliculitis et Perifolliculitis capitis abscedens et suffodiens (Hoffmann) (engl. dissecting cellulitis) angesehen wird. Betroffen sind von beiden Erkrankungen fast ausschließlich farbige Männer, also Afrikaner und Afroamerikaner, hier war es ein Hispanoamerikaner. In Nord- und Mittelamerika muss bei Tinea capitis vor allem mit T. tonsurans als Erreger gerechnet werden. Bei einem immunsupprimierten HIV-positiven Mann aus Indien wurde eine Tinea capitis circinata durch M. audouinii hervorgerufen . In Deutschland muss bei Tinea capitis im Erwachsenenalter in der Mehrzahl der Patienten mit T. rubrum als Erreger gerechnet werden, genau wie bei der Tinea incognito infolge einer Autoinokulation vom eigenen Körper .
Befallsmuster der Haare und Haarwurzeln bei Tinea capitis
Dermatophyten zeigen an den Haarwurzeln entweder ein endotriches (Endothrix) oder ein ektotriches (Ektothrix) Befallsmuster. Bei Endothrix-Infektionen durch T. tonsurans, T. violaceum, T. soudanense und T. verrucosum sind die (Arthro-)Sporen und Myzelien mikroskopisch im Inneren des Haarschaftes zu erkennen, ohne dass die Kutikula zerstört worden ist. Bei der Ektothrix-Infektion durch M. canis, M. audouinii und T. interdigitale (zoophile Stämme) lagern sich Sporen und Pilzhyphen außen am Haarschaft an und bilden eine „Manschette“ aus.
Klinisches Bild der Tinea capitis
Man unterscheidet sechs verschiedene Formen der Tinea capitis .
1. „Grey patch“-Tinea capitis: Typisch sind scheibenförmige, alopezische Herde, die von einer grauen Schuppenschicht bedeckt sind. Die Haare brechen kurz über der Hautoberfläche ab, so dass ein „Stoppelfeld“-ähnliches Bild resultiert. Die entzündliche Komponente mit Erythem kann im Einzelfall vollständig fehlen. Die zoophilen Dermatophyten M. canis und T. Spezies von Arthroderma benhamiae verursachen diese kreisrunden, erythematösen, hyperkeratotischen, verkrusteten, schuppenden, zentrifugal wachsenden und alopezischen Areale (Abbildung ). Im Wood-Licht – UV-Lampe, welche UVA-Strahlung von 365 nm emittiert – zeigen M.-canis-Infektionen eine grünlich-gelbe Fluoreszenz. Der Favus durch T. schoenleinii mit Ausbildung von Scutulae kann als Pityriasis amiantacea verkannt werden .
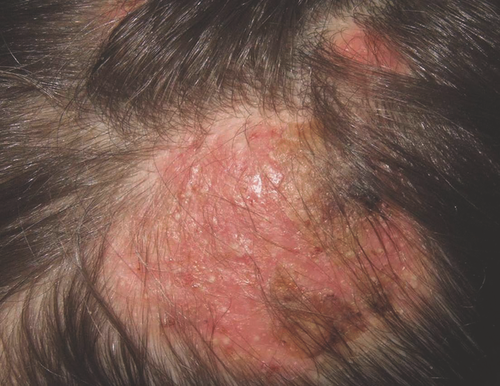
2. „Mottenfraß“-artige (moth eaten) Tinea capitis: Diese Form der Tinea capitis sollte – bei Erwachsenen – nicht mit einer Alopecia specifica diffusa syphilitica verwechselt werden . Diese seltene Form einer Syphilis im Stadium 2 wird klinisch auch als „Mottenfraß“-artige Alopezie bezeichnet.
3. „Black dot“-Form der Tinea capitis: Die wenig entzündliche Tinea-Form entsteht als Restzustand der in Hautniveau abgebrochenen Haarschäfte bei Infektionen durch Trichophyton-Arten, z. B. T. tonsurans, T. interdigitale, T. soudanense oder T. violaceum, jedoch auch durch M. audouinii (Abbildung ).
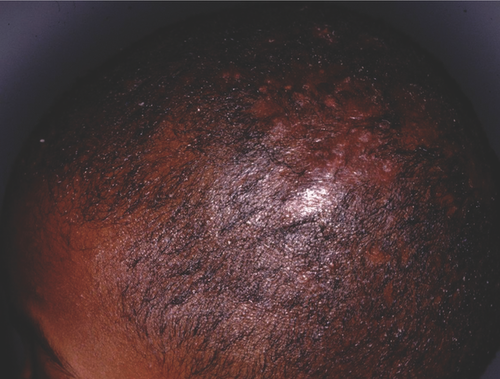
4. Pityriasis-capillitii-artige Tinea capitis: Auffällig ist eine diffuse Schuppung der Kopfhaut ohne Entzündungsreaktion. Erreger sind z. B. T. tonsurans und M. audouinii.
5. Pustulöse Form der Tinea capitis: Gelbliche Pusteln sind das morphologische Kriterium.
6. Kerion Celsi: Es handelt sich um die Maximalvariante der Tinea capitis, eine Abszess-artige tiefe Infektion der Kopfhaut. Eine Immunreaktion (hypersensitivity reaction) führt beim Kerion zur Granulom-Bildung . Symptome sind Schmerzen, Abgeschlagenheit und nuchale bzw. zervikale Lymphknotenschwellung, Fieber tritt selten auf. Diese Tinea capitis profunda sieht man bei Infektionen durch zoophile Dermatophyten, z. B. T. interdigitale oder T. verrucosum, aber auch bei Trichophyton Spezies von Arthroderma benhamiae. Die Haare im Randbereich lassen sich leicht epilieren. Im Wood-Licht ist im Falle von T. verrucosum keine Fluoreszenz erkennbar.
Infektionen der Augenbrauen
Die Infektion der Augenbrauen durch Dermatophyten wird ebenfalls dem Formenkreis der Tinea capitis zugeordnet. Die Behandlung ist wegen des langsamen Wachstums der Brauen erfahrungsgemäß langwierig und hartnäckig.
Dermatophyten auf der Kopfhaut: Tinea capitis oder lediglich Carrier-Status?
Bei einer Tinea capitis superficialis durch anthropophile Dermatophyten sind die Alopecia-areata-ähnlichen Herde am behaarten Kopf meist trocken, mehr oder weniger erythematös, hyperkeratotisch und schuppend. Manche Kinder sind lediglich Träger des Erregers. So führt insbesondere T. tonsurans, aber auch M. audouinii, oft nur zu einer diskreten Pityriasis capillitii. Bei 5,7 % von 194 türkischen Ringkämpfern war T. tonsurans nachweisbar, meist auf der behaarten Kopfhaut, fast alle waren damit lediglich asymptomatische Carrier . Ihnen kommt, wenn sie nicht behandelt sind, eine bedeutende Rolle bei der Übertragung der Tinea capitis innerhalb dieser Population zu. Im Einzelfall verursacht T. tonsurans hartnäckige und langwierige Dermatomykosen. Ein 12-jähriges japanisches Mädchen litt an einer über zehn Jahre rezidivierenden Tinea corporis und Tinea faciei durch T. tonsurans ausgehend von einer asymptomatischen Tinea capitis .
Sekundäre bakterielle Infektion der Tinea capitis
Sekundäre bakterielle Infektionen der Tinea capitis sind möglich, gelegentlich führen sie in eine falsche therapeutische Richtung, so dass lokal und systemisch antibiotisch behandelt wird. Im Einzelfall erfolgen nicht notwendige chirurgische Interventionen, von der Inzision bis zur Abszessausräumung. Die konventionelle mykologische Diagnostik ist bei langsam wachsenden Dermatophyten, z. B. T. verrucosum, zunächst negativ, so dass andere Erreger, meist Bakterien, an erster Stelle Staphylococcus aureus, als ursächlich angesehen werden. Eigentlich sind diese Bakterien jedoch nur Ausdruck einer sekundären Infektion der Tinea capitis (profunda). Eine sekundäre Infektion durch einen LA-MRSA (lifestock associated methicillin-resistant Staphylococcus aureus) kann bei einer eitrig-abszedierenden Tinea capitis durch T. verrucosum zu erheblichen diagnostischen und therapeutischen Problemen führen .
Tinea gladiatorum corporis et capitis durch Trichophyton tonsurans
T. tonsurans wird häufig indirekt über kontaminierte Matten beim Ringkampf übertragen. Daher stammt auch die Bezeichnung Tinea corporis oder Tinea capitis gladiatorum. Mikrotraumen beim Schürfen der Haut auf der Matte sind Eintrittspforten für den Dermatophyten in das Stratum corneum der Epidermis. Die direkte Übertragung zwischen den Kindern und Jugendlichen beim Ringkampf durch Hautkontakt ist dagegen weniger wahrscheinlich.
Klinisches Bild der Onychomykose
Onychomykose
Der Anteil der Onychomykosen an allen Nagelerkrankungen ist mit 50 % sehr hoch. Etwa 2–3 % der weltweiten Bevölkerung leiden schätzungsweise an einer Nagelpilzerkrankung. In Deutschland beträgt die Prävalenz der Onychomykose laut der „Foot Check-Studie“ 12,4 %. Durch die Überalterung der Gesellschaft in den Industrienationen steigt zwangsläufig die Inzidenz der Onychomykose.
Tinea unguium meint eine Onychomykose, die durch einen Dermatophyten verursacht ist, mit Abstand am häufigsten durch T. rubrum, nicht jedoch durch Hefe- oder Schimmelpilze. Der Begriff Onychomykose steht dagegen für eine Nagelpilzinfektion, welche durch Dermatophyten, Hefe- oder Schimmelpilze verursacht sein kann bzw. auch durch eine Kombination aus zwei (oder mehr) Pilzen aus den drei Gruppen.
Tinea unguium
Eine Nagelpilzinfektion beginnt überwiegend am distalen, freien Rand der Zehennägel als distale subunguale Onychomykose (DSO). Der Erreger wandert vom Hyponychium an der Unterseite der Nagelplatte von distal langsam nach proximal zur Matrix. Daraus wird im weiteren Verlauf eine laterale oder distolaterale subunguale Onychomykose (DLSO). Der Nagel ist hyperkeratotisch verdickt, gelbbraun gefärbt. Im Verlauf kommt es zur Onycholyse. Die yellow streaks entsprechen den sogenannten Dermatophytomen und weisen auf eine Matrixbeteiligung der Onychomykose hin (Abbildung ).
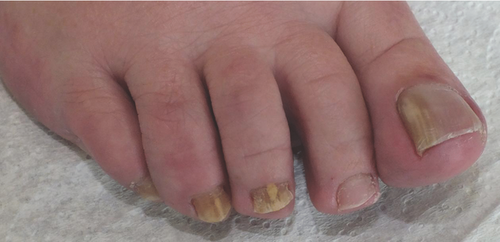
Die proximal subunguale Onychomykose (PSO) tritt eher selten auf. Ausgehend vom proximalen Nagelwall bei gleichzeitiger Tinea pedis geht der Erreger auf die Kutikula, später auf das Eponychium (Epithel der Unterseite des proximalen Nagelwalles) über. Man sieht die PSO häufiger bei immunsupprimierten Patienten, vorzugsweise bei HIV-Positiven sowie AIDS-Kranken. In Ländern mit hoher HIV-Prävalenz, z. B. im Sub-Sahara-Afrika, ist die Assoziation der PSO mit HIV/AIDS eklatant.
Die Leukonychia trichophytica bzw. weiße superfizielle Onychomykose (WSO) entwickelt sich bei oberflächlichem Befall der Nagelplatte mit einem Dermatophyten, es handelt sich meist um T. rubrum, aber auch T. interdigitale wird hier isoliert. Auf der Nagelplatte entsteht ein flacher, manchmal die gesamte Oberfläche des Nagels überziehender leuchtend-weißer Plaque-artiger Belag. Eine Sonderform ist die proximale weiße subunguale Onychomykose (PWOM) mit weißer Verfärbung unter dem proximalen Teil der Nagelplatte. Erreger sind neben T. rubrum auch T. schoenleinii (nicht in Deutschland) und Epidermophyton floccosum. Eine weitere Sonderform ist die schwarze superfizielle Onychomykose durch den Schwärzeschimmelpilz Hendersonula toruloidea (taxonomisch heute Nattrassia mangiferae).
Bei der endonychialen Onychomykose fehlt die subunguale Hyperkeratose, es tritt keine Onycholyse auf. Die Nägel sind bei dieser Form der Onychomykose hyperkeratotisch verdickt und weiß gefärbt. T. soudanense verursacht diese Onychomykose-Form, so dass in Afrika mit dieser Variante der Onychomykose gerechnet werden kann.
Die Maximalvariante der Onychomykose ist die totale dystrophische Onychomykose (TDO) (Abbildung ). H. Grimmer prägte in den 60er Jahren des letzten Jahrhunderts den Begriff des Gletscher-Nagels. Zur Gründungsversammlung der Deutschsprachigen Mykologischen Gesellschaft am 15.1.1961 in Essen hielt er den Vortrag „Histologische Untersuchungen bei Nagelmykosen (Nachweis vegetativer Pilzelemente und deren Bedeutung für die Griseofulvin-Therapie)“. Grimmer schrieb damals, von Ausnahmen abgesehen, „stellt die Lokalisation einer Pilzerkrankung durch Hyphomyzeten primär eine subunguale Mykose und keine Onychomykose im eigentlichen anatomischen Sinne dar… Die Reaktion des Epithels des Nagelbettes auf die pathogene Wirkung des Hyphomyzeten ist eine evtl. recht erhebliche Akanthose sowie wechselnde starke Hyperkeratose, die sich klinisch in einer Anhebung der Nagelplatte äußert.“ Die gesunde, nachwachsende Nagelplatte schiebt sich „nach Art eines Gletschers über das hyperkeratotische Nagelbett hinweg“ . Sie entsprechen den subungualen Dermatophytomen, Konglomeraten von Pilzelementen – Arthrosporen, Pilzhyphen und Hornmassen – unterhalb der gelblich-braun verdickten Nagelplatte. Eine für diese Onychomykose charakteristische Ausprägungsform sind die „gelben Streifen“, die als Längsstreifen medial oder lateral oft die Nagelmatrix erreichen.
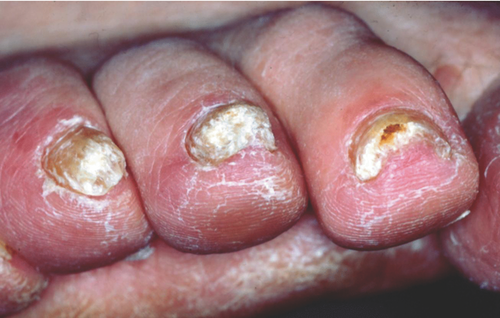
Der gesamte Nagel ist mykotisch infiziert und wird durch die subungualen Hyperkeratosen nach oben geschoben, so dass sich eine Onycholyse entwickelt. Bei der chronischen mukokutanen Candidose sind infolge einer von der Schleimhaut-Candidose des Mundes und der Zunge ausgehenden Autoinokulation die Fingernägel durch Hefepilze infiziert und imponieren klinisch als TDO .
Die Onychia et Paronychia candidosa wird dagegen durch Hefepilze verursacht. Dem Nagelbefall durch Sprosspilze geht eine chronische Infektion des proximalen und/oder lateralen Nagelwalls voraus, oft auch eine bakterielle Paronychie. In der Folge kommt es durch Matrixschädigung zu einer Störung der Struktur der Nagelplatte mit Querrillen. Daraus kann die Candida-Onycholyse (ohne Befall der Nagelplatte) als eigenständiges Krankheitsbild entstehen.
Onychomykose bei Kindern
Neuerdings fällt eine Zunahme der Nagelmykosen in der Kindheit auf. Die Prävalenz der Onychomykose im Kindesalter liegt bei 0 % bis 2,6 % . Hauptsächliche Ursache für eine Onychomykose im Kindesalter ist die Zunahme von Fuß- und Nagelpilzinfektionen im häuslichen Umfeld, d. h. bei Eltern und Großeltern, evtl. auch Geschwistern. Zumeist liegt bei der Onychomykose im Vorfeld eine Tinea pedis vor. Sportaktivitäten wie z. B. Fußball sind fördernd. Weniger bekannt, aber sehr häufig ist die Onychomykose bei Kindern mit Trisomie 21. Weitere signifikante disponierende Faktoren sind Adipositas und Diabetes mellitus.
2002–2007 waren an der Universitätshautklinik Bologna in Italien 15 Kinder mit Onychomykose vorstellig, von denen 53 % dieselben disponierenden Faktoren wie Erwachsene aufwiesen, d. h. eine Onychomykose in der Familie, Dermatophyten-kontaminierte Umgebung sowie sportliche Aktivitäten . Candida-Onychomykosen fanden sich bei unreifen Neugeborenen mit unvollständig entwickeltem Immunsystem, Kindern mit chronischer mukokutaner Candidose und bei iatrogener Immunsuppression.
In einer retrospektiven Untersuchung über fünf Jahre am Children's Hospital Colorado Denver at Health Medical Center Dermatology in den USA litten unter 141 Kindern mit Nagelerkrankungen insgesamt 66 (46,8 %) an einer Onychomykose. Die Altersgruppe der 6- bis 10-Jährigen wies die höchste Prävalenz der Onychomykose auf .
Am Institut für Pilzkrankheiten und Mikrobiologie Berlin wurden von 2008 bis 2009 unter 1 586 Patienten 24 Kinder im Alter von 4–14 Jahren mit Onychomykose erfasst. Das entsprach einem Anteil der Kinder von 1,5 %.
Hefepilzinfektionen durch Candida-Arten
Orale Candidose
Candidosen der Mundschleimhaut (Soor) betreffen in der Regel immunsupprimierte Patienten. Lokale Faktoren begünstigen ebenfalls eine Schleimhautinfektion durch Candida (C.) albicans, z. B. Zahnprothesen bei älteren Menschen, aber auch Zahnspangen bei Kindern und Jugendlichen. Bei der chronisch-atrophischen oralen Candidose sind Zunge und Mundschleimhaut hochrot, so z. B. bei der sogenannten Prothesen-Stomatitis. Eine weitere Form der Candidose ist die hyperplastische Schleimhautinfektion (rhomboidale Glossitis oder Glossitis rhombica mediana; engl.: midline glossitis). Die pseudomembranöse Candidose der Zunge entspricht dem landläufigen „Soor“. Symptome der Schleimhaut-Candidose sind Brennen und gelegentlich Schmerzen.
Die Candida-Leukoplakie betrifft Zunge und bukkale Mundschleimhaut. Differenzialdiagnosen sind orale Leukoplakie, Lichen ruber mucosae, prämaligne Läsionen, das Plattenepithelkarzinom der Mundschleimhaut, bullöse Dermatosen wie der Pemphigus vulgaris und das Stevens-Johnson-Syndrom.
Perlèche oder Angulus infectiosus („Faulecke“ am Mundwinkel) sind charakteristisch für Zahnprothesenträger. In Ländern mit hoher AIDS-Prävalenz kann die Perlèche auch erstes klinisches Zeichen der immunsupprimierenden Erkrankung sein. Sehr selten ist die Candida-Cheilitis. An die Soor-Ösophagitis – z. B. bei HIV/AIDS-Patienten – muss bei retrosternalem Brennen und massiven Schluckbeschwerden gedacht werden.
Hautinfektionen durch Candida-Arten
Candidosen der Haut betreffen überwiegend die intertriginösen Areale, das sind die Leisten, Bauchfalten, submammäre Haut, aber auch Finger- und Zehenzwischenräume (Candidosis interdigitalis) (Abbildung a, b). Die interdigitale Mykose durch C. albicans an den Händen oder Füßen kann ebenfalls, wie der Soor oder die Perléche, in Gebieten mit hoher Prävalenz von HIV, beispielsweise im Sub-Sahara-Afrika in Uganda, ein Hinweiszeichen für eine manifeste AIDS-Erkrankung sein (Abbildung ).
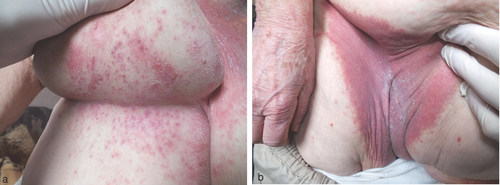

Typisch für die kutane Candidose sind erythematöse (hochrot bis livid-rot), randbetonte, erosive, trockene, schuppende und auch nässende sowie mazerierte Läsionen. Letzteres kommt vor allem bei der intertriginösen Candidose vor. Pusteln gehören ebenfalls zur typischen Morphologie einer kutanen Candidose. Bei Ausbreitung auf die freie Haut treten charakteristische erythrosquamöse Läsionen mit Collerette-artiger (Halskrausen-artiger) Schuppung auf.
Eine Sonderform der kutanen Candidose ist die Windeldermatitis (Candidosis genito-glutealis infantum). Hier stehen Mazeration und Erosion, jedoch auch die weißen Beläge und Schuppung im Vordergrund. Disponierend ist das feucht-warme Milieu, dazu kommt als irritierender Faktor der Urin. Gleichartig sind die Hautveränderungen bei Windeldermatitis bettlägeriger und inkontinenter älterer Patienten. Differenzialdiagnostisch zu berücksichtigen sind Kontaktdermatitiden, Ekzeme anderer Genese und Psoriasis inversa, bei denen es zu einer sekundären Besiedlung und manchmal nachfolgenden Infektion der Haut mit Candida spp. kommt.
Im Gesicht tritt bei Männern gelegentlich die Folliculitis barbae candidomycetica auf, die erst anhand des Ergebnisses der mikrobiologischen Untersuchung von einer bakteriellen Follikulitis oder einer Tinea barbae durch Dermatophyten, z. B. T. verrucosum oder T. rubrum, unterschieden werden kann. Selten sind tiefe Haut-Weichgewebe-Infektionen durch C. albicans.
Pityriasis versicolor – klinisches Bild
Prädilektionsstellen für die Pityriasis versicolor sind oberer Stamm, Rücken, Brust, Dekolleté, Schultern und Oberarme. Seltener sind auch die Leisten und Oberschenkel einbezogen. Typisch sind anfänglich braunrote (Pityriasis versicolor rubra), makulöse, ovale und kreisrunde, konfluierende, flache, konfigurierte, scheinbar nicht schuppende Läsionen. Bei dieser hyperpigmentierten und makulösen Form der Pityriasis versicolor besteht meist kein Juckreiz (Abbildung a). Die makulösen Läsionen sind hellbraun gefärbt (Milchkaffee) und breiten sich unregelmäßig begrenzt, „Landkarten“-förmig aus . Durch tangentiales Schaben (Holzspatel, Skalpell) ist eine „Kleie“-förmige Schuppung auslösbar, das bekannte „Hobelspanphänomen“ (Abbildung b). Bei Europäern besteht ein auffälliger Kontrast zwischen braunen Hautarealen (UV-Strahlen, infolge Sonnen, Solarium) und den blassen, hypopigmentierten Läsionen. In den Tropen findet sich die Pityriasis versicolor alba, die weiße, pseudochromatische Form der Pityriasis versicolor. Die perifollikuläre Form der Pityriasis versicolor beschränkt sich auf die Follikel.
Eine seltene Manifestation der Pityriasis versicolor ist die areoläre und periareoläre Pityriasis versicolor mit hellbraunen Maculae an den Mamillen .
Die Pityriasis versicolor betrifft niemals das Gesicht. Eine Ausnahme sind farbige Patienten in tropischen Ländern, bei denen im Einzelfall typische Hautveränderungen mit Hypo- und Hyperpigmentierungen auch im Gesicht auftreten können.
Mykologische Labordiagnostik
Die dermatomykologische Diagnostik beruht auf dem mikroskopischen und kulturellen Erregernachweis. Eine alte Regel besagt, dass bei einem positiven mikroskopischen Präparat topisch antimykotisch behandelt werden kann. Erst nachdem die kulturelle Untersuchung einen Erreger ergeben hat, sollte bei entsprechender Indikation die systemische antimykotische Therapie gestartet werden.
Materialentnahme
Neben Hautschuppen werden bei Verdacht auf eine Tinea capitis Haarwurzeln und bei Onychomykose Nagelspäne entnommen (Tabelle ). Insbesondere bei Tinea capitis durch anthropophile Dermatophyten, vor allem T. tonsurans, ist die sogenannte Haarbürstenmethode (hairbrush method) dem Abschaben (scalp scraping) von Kopfschuppen signifikant überlegen (Tabelle ) . Unmittelbar nach dem Durchbürsten der Kopfhaut und Haare wird die Bürste mit leichtem Druck direkt auf die Pilznährmedien (Agarplatte) aufgedrückt. Auf diese Weise ist nur der kulturelle Pilznachweis möglich . Die Bürstendiagnostik hat bei Tinea capitis durch anthropophile Pilze (T. tonsurans und M. audouinii) Sinn, da die Kopfschuppung im Vordergrund steht. Bei eitrigen Infektionen ist die Epilation der Haare und ggf. Abstrich-Entnahme von Vorteil. Die Bürstenmethode hat sich für Screening-Untersuchungen von Familienmitgliedern und Kindern in Kindergarten und Schule bewährt. Für das einzelne Kind in der Kinder- oder Hautarztpraxis ist die Entnahme von Kopfschuppen und Haarwurzeln mit Skalpell und Pinzette vorzuziehen.
Tabelle 3. Entnahme von Untersuchungsmaterialien für die mykologische Diagnostik
| Form der Dermatomykose | Instrument zur Materialentnahme | Vorgehen |
|---|---|---|
| Tinea corporis randbetonte, trockene, schuppende Plaques | Skalpell, scharfer Löffel | Schuppen aus dem (entzündlichen) Randbereich der Läsionen |
| Tinea pedis interdigitalis et plantaris | Abstrichtupfer zur Gewinnung von Schuppen scharfer Löffel, Skalpell | Kräftiges Reiben mit dem Tupfer, um Schuppen zu gewinnen, bzw. Abschaben der Hautschuppen mit der Kürette. Zur mikrobiologischen Diagnostik kann auch der Abstrichtupfer direkt auf den Pilznährboden ausgestrichen werden.Skalpell: Schuppen von den trockenen, hyperkeratotischen Arealen der Fußsohle abschaben. |
| Tinea unguium (Onychomykose) | Skalpell, scharfer Löffel, (Schere), Fräse (ggf. in der Podologie) | Desinfektion mit 70 % Ethanol, alternativ ein anderes Hautantiseptikum. Die Desinfektion wird heute als optional angesehen, da zur mykologischen Diagnostik selektive Nährmedien verwendet werden und Kontaminationen darauf nicht wachsen. Nagel ggf. mit Schere kürzen, Nagelstücke verwerfen, danach die Nagelplatte tangential abtragen. Die kleinen und mittelgroßen subungualen krümeligen, z. T. faserigen Nagelspäne am Übergang vom „kranken“ zum „gesunden“ Gewebe sind das optimale Material für die mykologische Untersuchung.Alternative: (hochtourige) elektrische Nagelfräse (Podologie) |
| Tinea capitis | Epilationspinzette, Skalpell | ▸ Kürzen der Haare mit der Schere auf ca. 3–5 mm Länge, Verwerfen der abgeschnittenen Haare, mit Epilationspinzette ca. 10–20 Haarwurzeln entnehmen. ▸ Kopfschuppen mit dem Skalpell abschaben ▸ von Pusteln oder eitriger Abszedierung mit Abstrichtupfer Material entnehmen ▸ Bürstenmethode: mehrmaliges Kämmen der Haare mit steriler Kopfmassagebürste (alternativ Zahnbürste), danach direkte Beimpfung auf Pilznährmedien (Agarplatte) |
Mikroskopisches Präparat
Einfachste Methode des mikroskopischen Pilznachweises in Hautschuppen, Nagelmaterial und Haarwurzeln ist das Nativpräparat mit 20%iger Kalilauge (KOH), alternativ mit Tetraethylammoniumhydroxid (TEAH). Die konventionelle Diagnostik mittels Kalilaugenpräparat weist – insbesondere bei der Onychomykose – eine ungenügende diagnostische Empfindlichkeit auf (40–68 %). Die empfindlichste Methode zum mikroskopischen Pilznachweis in Hautschuppen, Nagelspänen, Haarwurzeln, Haaren sowie Tesa-Film-Abrissen der Haut ist die Fluoreszenzfärbung mit optischen Aufhellern aus der Gruppe der Diaminostilbene. Diese binden sich am Chitin, dem Hauptbestandteil der Zellwand der Pilze. Verfügbare Farbstoffe sind Blankophor® oder Calcofluor®. Die Gebrauchslösung wird mit 20%iger KOH-Lösung hergestellt. Mittels Fluoreszenzmikroskop werden Sporen, Sprosszellen, bis zu den sehr kleinen Malassezia-Sprosszellen, sowie Hyphenstücke und Arthrosporen (zerfallendes Myzel) unterschieden.
Kultureller Dermatophyten-Nachweis
Pilze sind heterotrophe Mikroorganismen. Die Nährmedien enthalten deshalb die für Wachstum und Fortpflanzung nötigen organischen Nährstoffe, u. a. eine C-Quelle (Glukose), eine N-Quelle (Pepton, Fleischextrakt), Wasser, Vitamine, außerdem Antibiotika.
Von jeder Materialprobe sollten zwei Nährböden beimpft werden, einer davon enthält Cycloheximid (Actidion®) zur Unterdrückung des Schimmelpilzwachstums. Der Ansatz wird bei 26–32 °C, am besten bei 28 °C, über drei (ggf. vier) Wochen inkubiert und zweimal wöchentlich visuell auf Pilzwachstum kontrolliert. Die meisten Dermatophyten wachsen zwar auch bei 37 °C, jedoch aufgrund der Adaptation an die menschliche Hautoberflächentemperatur etwas besser bei niedrigeren Temperaturen. Wenn Verdacht auf einen langsam wachsenden Dermatophyten, z. B. T. verrucosum oder T. violaceum, geäußert wurde, sollte mindestens vier Wochen, besser noch 5–6 Wochen bebrütet werden.
Erwähnt werden soll auch der Dermatophyten-Selektivagar nach Taplin, ein sowohl Selektiv- als auch gleichzeitig Differenzierungsmedium. Der Zusatz von Cycloheximid erlaubt selektiv Dermatophyten das Wachstum auf dem Nährmedium. Man sollte wissen, dass auch einige wenige Schimmelpilze in der Lage sind, sich trotz des Hemmstoffes auf dem Agar zu entwickeln. Dermatophyten produzieren basische Stoffwechselprodukte, die den primär sauren Nährboden alkalisieren, wodurch der enthaltene Indikator Phenolrot von gelb nach rot umschlägt und anhand dieser Farbe auf das Wachstum eines Dermatophyten rückgeschlossen werden kann.
T. interdigitale (T. mentagrophytes) entwickelt kein an T. rubrum erinnerndes Pigment. Dieses wichtige Unterscheidungskriterium der beiden häufigsten Dermatophyten kann auf einem Farbstoff-Agar nicht beurteilt werden. Am besten gelingt dies nach wie vor auf der Grundlage von Sabouraud 2 % oder 4 %-Glukose-Agar. Medien mit einem chemisch bedingten Farbumschlag (z. B. der o. g. Taplin-Agar) sind dagegen ungeeignet, weil sie das natürliche Pigment der Erreger verdecken, was auch für andere pigmentbildende Dermatophyten gilt.
Die Differenzierung der Dermatophyten, Hefe- und Schimmelpilze erfolgt anhand makromorphologischer (Kolonieoberseite und -unterseite sowie Pigmentierung) und mikromorphologischer Charakteristika (Ausbildung von Makro- und Mikrokonidien bzw. anderer Wachstumsformen) sowie biochemischer Eigenschaften (beispielsweise Harnstoff-Spaltung auf Christensen-Agar) . Der kulturelle Pilznachweis versagt relativ häufig (Empfindlichkeit ca. 70 % bei Onychomykose). Ursache dafür ist die Vorbehandlung mit einem topischen oder systemischen Antimykotikum, so dass vitale Pilze schon in vivo gehemmt sind und in vitro nicht zum Wachsen kommen können.
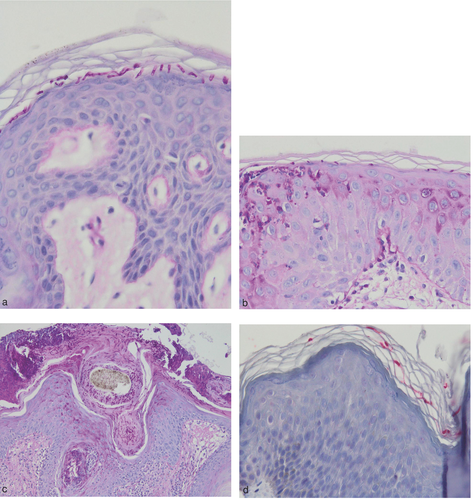
Histologischer Pilznachweis
Bei Tinea corporis finden sich die Pilzhyphen im Stratum corneum bzw. auch in den follikulären Strukturen der Epidermis (Abbildung a–d). Der histologische Nachweis von Pilzen bei Nagelpilzinfektionen weist eine hohe Empfindlichkeit auf. Die Spezifität ist jedoch gering, da nicht auf die Pilzgattung oder -art geschlossen werden kann. Üblicherweise wird eine Stanzbiopsie aus der Nagelplatte für die Diagnostik einer PSO oder PSWO entnommen, für andere Formen der Onychomykose reichen auch Nagel-Clippings . Die histologische Untersuchung des Nagels durch einen auf diesem Gebiet erfahrenen Histopathologen ist essentiell zum Ausschluss diverser differenzialdiagnostisch in Betracht kommender Nagelerkrankungen, z. B. Yellow-Nail-Syndrom, Lichen planus unguium, Psoriasis unguium, Twenty-Nail-Dystrophie, kongenitale und erworbene Onychodystrophien (Brachyonychie), subunguale Tumoren und Melanonychia .
In einer Studie an der New York University wurden über acht Monate alle unter dem Verdacht auf Onychomykose eingesandten Nagelproben histologisch untersucht, insgesamt ließ sich bei 66 Patienten eine Onychomykose nachweisen . Bei 97 % fanden sich subungual Hyphen. Bei den restlichen 3 % waren Hyphen nur im Material aus der Nagelplatte vorhanden, nicht aber im subungualen Gewebe. Die histologische Diagnostik der Onychomykose stellt eine sehr empfindliche Methode dar. Herbst et al. setzten den histologischen Pilznachweis als Zusatzuntersuchung bei Patienten, bei denen sich der klinische Verdacht auf eine Onychomykose auch durch wiederholte Nativuntersuchungen und Pilzkulturen nicht erhärten ließ, ein. Von 32 histopathologisch nachgewiesenen Onychomykosen war bei nur 14 von 29 (48 %) die Pilzkultur positiv.
Zehn Patienten mit der Verdachtsdiagnose einer mykotischen Leukonychie wurden kulturell auf Pilze untersucht, außerdem wurde eine Nagelbiopsie entnommen . Bei neun Patienten ließ sich die Diagnose einer mykotischen Leukonychie bestätigen. Lediglich bei vier Patienten war der Erreger kulturell nachweisbar, alle wiesen jedoch Pilzelemente in der HE- und Periodic-Acid-Schiff (PAS)-Färbung auf. Letztlich bestand eine 100%ige Korrelation der Onychomykose mit dem Ergebnis der histologischen Untersuchung.
Kritikpunkt ist, dass die histologische Untersuchung keinen Rückschluss auf die verursachende Pilzgattung oder -spezies ermöglicht, selbst zwischen Dermatophyten, Hefe- oder Schimmelpilzen kann nicht differenziert werden.
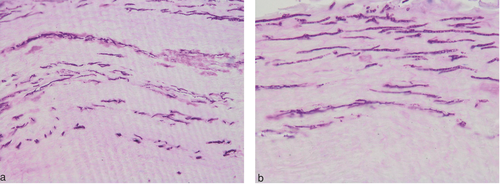
Insgesamt hat sich die Histomykologie in den Praxen und Kliniken, die sie durchführen, als schnelle und nahezu doppelt so sensitive Methode wie die Pilzkultur erwiesen . Insbesondere wenn Pilze weder mikroskopisch noch kulturell nachweisbar sind, ist eine histologische Untersuchung von Nagelmaterial diagnoseweisend (Abbildung a, b). Inwieweit histologisch vom Pathologen beschriebene „PAS-positive“ Pilzelemente tatsächlich der Beweis für eine Onychomykose sind, muss im Einzelfall vom Dermatologen kritisch auf Plausibilität hinterfragt werden, um nicht sekundäres mykotisches Wachstum beispielsweise bei Psoriasis unguium „falsch-positiv“ als Nagelpilzinfektion zu interpretieren.
Molekularbiologischer Pilznachweis in der Dermatomykologie
Uniplex-PCR zum Direktnachweis von Dermatophyten im klinischen Material
Neue molekulare Methoden sollen die „diagnostische Lücke“, welche Präparat und Kultur lassen, schließen und die Empfindlichkeit sowie Spezifität der mykologischen Diagnostik erhöhen . Nukleinsäureamplifikationstechniken (NAAT) nutzen Primer – Nukleinsäuresequenzen, die spezifisch Genabschnitte der einzelnen Dermatophyten-Arten erkennen – zum spezifischen Erregernachweis im klinischen Material in vitro. Zum Direktnachweis der Dermatophyten aus Nagelmaterial und Hautschuppen ist eine Polymerasekettenreaktion (polymerase chain reaction; PCR) als PCR-Elisa-Assay als In-House-Assay verfügbar . Als spezifische Sequenz für die Primer wird ein Teil des Topoisomerase-II-Gens, für einzelne Dermatophyten auch eine Sequenz der Internal-Transcribed-Spacer (ITS)-Region genutzt . Der Uniplex-PCR-Elisa-Test erfasst separat T. rubrum, T. interdigitale, Epidermophyton floccosum, M. canis, T. tonsurans, T. verrucosum, T. violaceum und T. Spezies von Arthroderma benhamiae. In einer Pilotstudie betrug die diagnostische Empfindlichkeit des Blankophor®-Präparates im Vergleich zur Kultur 80,1 %, die Spezifität 80,6 %. Die diagnostische Sensitivität der Kultur auf Dermatophyten lag bei 82,1 %. Mit 85,8 % war die Sensitivität der PCR im Vergleich zur Kultur höher.
Die Dermatophyten-PCR kann, nach Rücksprache mit der zuständigen Kassenärztlichen Vereinigung, als Kassenleistung abgerechnet werden. Darüber hinaus sind die molekularbiologischen Laboruntersuchungen auch in der GOÄ abgebildet und für Privatpatienten abrechenbar.
Die PCR auf Dermatophyten erhöht den Anteil positiver Ergebnisse, die Zeit bis zur Diagnosestellung wird verkürzt (24-Stunden-Diagnostik). Die Methode ist wirtschaftlich, lediglich der Personalaufwand ist hoch. Mittelfristig wird die konventionelle dermatomykologische Diagnostik durch molekulare Techniken ergänzt werden. Denkbar sind z. B. einfache Analysensysteme auf PCR-Basis, die in der Hautarztpraxis eine Dermatophyten-Sofort-Diagnostik erlauben .
Multiplex-PCR zum Pilznachweis in der Dermatomykologie
Ein kommerziell verfügbarer Multiplex-PCR-Test ermöglicht die simultane Amplifikation von 21 Dermatomykose-Erregern (Dermatophyten, Hefen und Schimmelpilzen), deren DNA mittels Agarosegelelektrophorese detektiert wird . Die Identifizierung erfolgt für einige der Erreger bis zur Spezies-Ebene (z. B. E. floccosum, M. canis, M. gypseum, T. rubrum, Scopulariopsis brevicaulis). Andere Erreger werden jedoch nur innerhalb der Gattung erkannt (z. B. Candida spp., Aspergillus spp.).
Real-Time-PCR zum Dermatophyten-DNA-Nachweis
Die Real-Time-PCR („Echtzeit“-Polymerasekettenreaktion) zum direkten Nachweis von Dermatophyten aus klinischem Material ist zwar apparativ aufwendig (LightCycler), wenn jedoch einmal etabliert, stellt sie eine vergleichsweise schnell durchführbare, hochspezifische und empfindliche molekulare Methode der Amplifizierung und gleichzeitigen Quantifizierung der DNA dar. Auch mit Real-Time-PCR können mehrere Erreger nachgewiesen werden, jedoch nicht gleichzeitig, sondern konsekutiv. Eine Untersuchung aus Frankreich zeigte, dass trotzdem auch kritisch mit den Ergebnissen der Real-Time-PCR umgegangen werden muss . Falsch-negative Ergebnisse sind möglich, vor allem infolge einer inhomogenen Verteilung der Dermatophyten-DNA im Haut- oder Nagelmaterial. Das Fazit der Studie lautet deshalb, dass im Moment auf die konventionelle Diagnostik nicht verzichtet werden sollte. Nach wie vor sind Nativpräparat (am besten als fluoreszenzoptisches Präparat mit Blankophor®/Calcofluor® oder die preiswerte Variante mit Acridiniumorange) und kultureller Pilznachweis die Grundlage der dermatomykologischen Diagnostik. Diese kann durch molekulare Methoden ergänzt werden, z. B. durch den Uniplex-PCR-Elisa-Assay oder die Real-Time-PCR zum Dermatophyten-DNA-Nachweis bzw. auch durch die Multiplex-Pilz-PCR.
Neue molekulare Methoden zur Dermatophyten-Differenzierung
Neben dem Direktnachweis von Pilzen im klinischen Material mit molekularen Techniken, wie z. B. der PCR, ist die MALDI-TOF (matrix-assisted laser desorption ionization-time of flight)-Massenspektrometrie (MS) als Kulturbestätigungstest zur Differenzierung von Fadenpilzen mittlerweile in größeren Laboren etabliert . Der Zeitvorteil ist immens, es lassen sich bis zu 64 Dermatophyten-Stämme gleichzeitig identifizieren, das Ergebnis liegt innerhalb von Minuten vor. In allen mittelgroßen und großen Laboren in Deutschland sind die Großgeräte für die MALDI-TOF-MS heute verfügbar. Die Spezifität der Bestimmung – anhand des Protein-Massen-Fingerprintabdrucks bzw. Massenspektrums – ist hoch. Trotzdem sollte immer die Plausibilität der differenzierten Spezies geprüft werden. Wenn beispielsweise die MALDI-TOF-MS-Analyse die Spezies T. tonsurans ergibt, das Isolat aber aus Nagelspänen einer 62-jährigen Patientin stammt, dann ist gesunde Kritik angebracht. Im konkreten Fall erbrachte die einfache mikroskopische Untersuchung im Lactophenol-Baumwollblau-Präparat eindeutige Merkmale von T. interdigitale, insbesondere massenhaft Spiralhyphen. Hier ist der mykologisch tätige Hautarzt aufgrund seiner klinischen Erfahrung eindeutig im Vorteil.
Interessenkonflikt
Keiner.
Literatur
Fragen zur Zertifizierung durch die DDA
- Die Tinea pedis betrifft die Haut der Fußsohlen und die Zehenzwischenräume, die oft mazeriert sind? Welche Erreger verursachen die Tinea pedis?
- Trichophyton rubrum und Trichophyton interdigitale
- Corynebacterium minutissimum
- Pseudomonas aeruginosa
- Staphylococcus aureus
- Candida albicans und Candida parapsilosis
- Welche Folgen kann eine Autoinokulation eines Dermatophyten (oft Trichophyton rubrum), ausgehend von einer Tinea pedis et unguium, haben? Welche Aussage ist falsch?
- Tinea inguinalis
- Tinea corporis glutealis
- Tinea faciei
- Tinea capitis
- eine systemische Pilzinfektion mit Befall innerer Organe
- Welche Lokalisation einer Dermatophytose gilt nicht als diagnostisches Kriterium eines Trichophyton-rubrum-Syndroms?
- Tinea inguinalis
- Tinea corporis
- Tinea pedis/Tinea manus
- Tinea unguium
- Tinea faciei
- Welche Aussage zur „One-Hand/Two-Feet-Mykose“ ist falsch?
- Die Dermatophytose betrifft meist die linke Hand.
- Erreger ist in der Regel Epidermophyton floccosum.
- Männer sind häufiger betroffen.
- Disponierend ist eine Hyperhidrosis manuum mit Links-Rechts-Asymmetrie.
- Es besteht eine Korrelation zur Pediküre, bei der es zur Autoinokulation der Pilze auf die linke Hand kommt.
- Die Tinea capitis gilt als häufigste Dermatophyten-Infektion im Kindesalter? Welche Aussage zur Tinea capitis trifft nicht zu?
- Erreger bei Kindern sind in Deutschland vorzugsweise zoophile Dermatophyten.
- In den USA wird die Tinea capitis oft durch anthropophile Dermatophyten verursacht.
- Erwachsene sind nie von einer Tinea capitis betroffen.
- Abhängig vom Erreger unterscheidet man ein endotriches (Endothrix) oder ein ektotriches (Ektothrix) Befallsmuster der Haare.
- Das Kerion Celsi gilt als Maximalvariante einer Tinea capitis.
- Welche Aussage ist falsch? Die „Black-dot“-Form der Tinea capitis…
- ist eine wenig entzündliche Tinea-Form.
- entsteht als Restzustand der in Hautniveau abgebrochenen Haarschäfte.
- wird durch Trichophyton-Arten, z. B. T. tonsurans, T. interdigitale, T. soudanense oder T. violaceum verursacht.
- kann auch durch Microsporum audouinii verursacht werden.
- wird nur auf farbiger Haut angetroffen.
- Welche Aussage zur mikrobiologischen Ursache einer Tinea unguium ist richtig? Zu den Erregern einer Tinea unguium zählt…
- Candida albicans.
- Candida parapsilosis.
- Trichophyton rubrum.
- Scopulariopsis brevicaulis.
- Hendersonula toruloidea, ein Schwärzeschimmelpilz.
- Welche Aussage zu „yellow streaks“ ist falsch?
- Es sind mediale oder laterale gelbe Längsstreifen im Nagel.
- „Yellow streaks“ weisen auf eine Matrixbeteiligung der Onychomykose hin.
- Es handelt sich dabei um sogenannte Dermatophytome unterhalb und im Nagel.
- Konglomerate aus Arthrosporen im Keratin bilden die „yellow streaks“.
- Sie sind ein Hinweiszeichen auf eine Schimmelpilzinfektion der Nägel.
- Welches diagnostische Verfahren hat die geringste Empfindlichkeit zum Nachweis einer Onychomykose?
- Blickdiagnostik
- Kalilaugenpräparat
- Blankophor-Präparat
- Pilzkultur
- Histologie
- Die PCR zum Nachweis von Dermatophyten direkt im klinischen Material (Hautschuppen, Nagelspäne) etabliert sich als zusätzliche diagnostische Methode in der Dermatomykologie? Welche Aussage stimmt nicht?
- Es werden Primer-Paare, die die Dermatophyten-DNA spezifisch binden, eingesetzt.
- Die PCR ist eine Nukleinsäure-Amplifikationstechnik.
- Zielstruktur ist das Gen der Topoisomerase II der Dermatophyten.
- Mit einem zweiten Primer- oder Sonden-Paar erfolgt die Detektion mittels ELISA.
- Die PCR wird lediglich als Kulturbestätigungstest eingesetzt.
Liebe Leserinnen und Leser,
der Einsendeschluss an die DDA für diese Ausgabe ist der 18. September 2014. Die richtige Lösung zum Thema „Kutane Lymphome“ in Heft 1 (Januar 2014) ist: (1a, 2e, 3a, 4b, 5c, 6e, 7c, 8e, 9a, 10e).
Bitte verwenden Sie für Ihre Einsendung das aktuelle Formblatt auf der folgenden Seite oder aber geben Sie Ihre Lösung online unter http://jddg.akademie-dda.de ein.




