Multimodaler optischer Scanner für die Hautkrebs-Diagnostik: Melanome schnell und zuverlässig erkennen
Zusammenfassung
Optische Technologien können dazu beitragen, den bisherigen Standard bei der Diagnose des malignen Melanoms der Haut, also invasive Biopsie und Histopathologie, zu ersetzen. Ein neuartiges multimodales System aus bildgebenden und spektroskopischen Methoden erfüllt alle Anforderungen wie kurze In-vivo-Messzeiten sowie automatisierte und verlässliche Klassifizierung der Hautläsionen. Es ist zudem nichtinvasiv, schmerzfrei und verlässlich. Es stellt objektivierbare Kriterien für eine verbesserte Diagnose zur Verfügung, spart Zeit und Kosten und kann somit die seit langem angestrebte optische Biopsie ermöglichen. Zukünftig können die weitergehende Kombination der eingesetzten optischen Messmethoden mit künstlicher Intelligenz sowie die Möglichkeiten der Minitaturisierung des multimodalen Systems die Funktionalität, Diagnosegenauigkeit und Echtzeitfähigkeit weiter erhöhen und die Zeit bis zur Therapie verkürzen. Auch eine Erweiterung auf andere Hautkrebstypen und Hautkrankheiten ist möglich.
Derzeit ist zur Erkennung von Hautkrebs die Entnahme einer Gewebeprobe und deren histologische Untersuchung notwendig. Dies ist invasiv, aufwendig und kostet viel Zeit. Aktuelle nichtinvasive Verfahren stoßen bei der Erfassung von Kontrast- und Tiefeninformationen an Grenzen. Ein neuartiges multimodales System kombiniert mehrere optische Technologien zur sicheren, berührungslosen und objektiven Diagnose von Hautkrebs. Es hat das Potenzial, die zukünftige dermatologische Praxis zu revolutionieren.
Die Haut ist das größte Organ des Menschen und anfällig für verschiedene Krankheiten, darunter auch Krebs. Die Inzidenzrate von Hautkrebs ist in den letzten Jahrzehnten kontinuierlich angestiegen, auch bedingt durch eine alternde Gesellschaft und vermehrte Aufenthalte in Gebieten mit hoher Sonnenexposition. Mit weltweit etwa 1,5 Millionen Neuerkrankungen pro Jahr gehört Hautkrebs zu den häufigsten Krebsarten. Das maligne Melanom der Haut, der schwarze Hautkrebs, ist die gefährlichste Hautkrebsart, da es oft gesunden Hautläsionen ähnelt und in einem sehr frühen Stadium mit wenigen – oder gar keinen – Symptomen metastasieren kann.
Im Jahr 2020 wurden weltweit etwa 325 000 neue Fälle von Melanomen diagnostiziert und 57 000 Todesfälle erfasst [1]. Erfolgt die Diagnose und chirurgische Entfernung des Melanoms in einem frühen Stadium, liegt die Wahrscheinlichkeit für eine Genesung bei etwa 95 % (Zehn-Jahres-Überlebensrate). Ein unbehandeltes Melanom, das erst in einem späteren Stadium entdeckt wird, kann Blutgefäße erreichen und in den benachbarten Lymphknoten sowie in Organen metastasieren, was zu einer drastischen Abnahme der Überlebensrate auf 10 % führt [2]. Die frühzeitige Identifizierung und Behandlung eines Melanoms ist deshalb von entscheidender Bedeutung für das Behandlungsergebnis.
Für eine verlässliche Diagnose und wirksame Therapie von Hautkrebs, insbesondere von Melanomen, ist eine präzise Messung der Infiltrationstiefe sowie der Malignität des verdächtigen Hautmerkmals entscheidend. Aktuell erfolgt die Diagnostik gemäß medizinischer Leitlinien durch chirurgische Probenentnahme und anschließende histologische Untersuchung. Diese ist jedoch invasiv und zeitaufwendig. Zudem bestätigt sich nur bei einer von etwa 40 Exzisionen – abhängig von der Erfahrung der Dermatologen – der Verdacht auf ein Melanom. Alle anderen Fälle sind gutartige Muttermale oder pigmentierte gutartige Hautveränderungen, die keiner medizinischen Behandlung bedurft hätten.
Die Infiltrationstiefe des Melanoms ist ein kritischer Parameter bei der Diagnose und Therapieplanung und spielt bei der Exzision eine Rolle. Sie kann nach histopathologischer Untersuchung (Goldstandard) mit zwei Verfahren eingeschätzt werden, die Clark-Skala sowie Tumordicke nach Breslow genannt werden. Dabei werden jedoch einzelne zweidimensionale (2D) Schichten der Läsion betrachtet, die möglicherweise nicht die Stelle der größten Ausdehnung wiedergeben. Daher besteht ein dringender Bedarf an neuen nichtinvasiven Konzepten, die hochauflösende und möglichst dreidimensionale (3D) Bilder von Hautläsionen liefern und zudem Aufschluss über die Malignität geben.
Wenn eine nichtinvasive und zudem schnelle Methode zur Verfügung stünde, stünden den Dermatologen objektivere Kriterien für eine präoperative Diagnostik zur Verfügung, und die Anzahl der chirurgischen Eingriffe würde sich deutlich reduzieren, derzeit sind es weltweit mehr als 30 Millionen pro Jahr. Zudem könnten die Untersuchung und, bei diagnostiziertem Melanom, die Exzision der Hautläsion und der angrenzenden Lymphknoten an einem einzigen Termin stattfinden. Aktuell wären dazu zwei Termine notwendig, zusätzlich zu einer Wartezeit von oftmals fünf bis zehn Tagen bis zur Diagnose durch die histopathologische Untersuchung.
Auf dem Gebiet der Hautdiagnostik wird intensiv an Methoden zur nichtinvasiven Untersuchung geforscht. Mit konfokaler Mikroskopie und Multiphotonenmikroskopie (MPM) konnte beispielsweise eine Unterscheidung zwischen gut- und bösartigen Hautläsionen erreicht werden. Beide Methoden sind jedoch in der Eindringtiefe (≤ 200 μm) in pigmentierter Haut und der Größe des Untersuchungsfelds begrenzt. Ebenso wurde die optische Kohärenztomographie (OCT) zur Messung der Infiltrationstiefe verwendet, jedoch ist sie lediglich bis zu einer Tiefe von ≤ 500 μm verlässlich. Für dickere Hautläsionen (≥ 1 mm) wurde auch Ultraschall (US) mit einer Frequenz ≥ 15 MHz eingesetzt. Teilweise konnte eine gute Übereinstimmung mit den Ergebnissen der Histologie erreicht werden.
OCT und US können bis dato jedoch keinen Aufschluss darüber geben, ob es sich um eine gesunde oder kranke Läsion handelt. Dazu kann die Raman-Spektroskopie herangezogen werden. Sie ist in der Lage, den molekularen Fingerabdruck einer Hautprobe zu ermitteln und Melanome von gutartigen Hautläsionen zu unterscheiden, durch Analyse der spektralen Signaturen der enthaltenen Moleküle. Schließlich wurden auch Studien mit hyperspektraler Bildgebung durchgeführt, die das Licht von einer beleuchteten Probe in verschiedene Kanäle aufteilt und Hautläsionen klassifizieren kann. Allerdings ist keine dieser Modalitäten bisher in der Lage, sowohl die Ausdehnung als auch die Malignität von Hautläsionen über den gesamten erforderlichen Tiefenbereich bis zirka 4 mm zu ermitteln, weshalb sie im klinischen Alltag nicht etabliert sind.
Häufig in der Dermatologie eingesetzte optische Methoden sind in Tabelle 1 aufgeführt. Die meisten ermöglichen entweder die Erkennung diagnostischer Marker oder die Messung der Infiltrationstiefe und Ausdehnung. Bei der konfokalen Mikroskopie ergeben sich zudem Limitierungen bei Eindringtiefe, Sichtfeld und Messdauer. Folglich herrscht Konsens darüber, dass nur eine Kombination von verschiedenen komplementären Modalitäten alle Anforderungen an eine nichtinvasive, verlässliche und schnelle Diagnostik erfüllen kann. Obwohl es möglich wäre, verschiedene Modalitäten nacheinander anzuwenden, ginge dieses mit einem deutlich höheren Zeitaufwand einher. Ein Nachteil wäre zudem, dass sich die so aufgenommenen Bilder nur schwer überlagern lassen.
| Optische Methode | Messgröße | Diagnostische Relevanz | Ausdehnung/Infiltrationstiefe |
|---|---|---|---|
| Konfokale Mikroskopie | Zell-Lumineszenz | ✓ | ✓ |
| Raman-Spektroskopie | Molekulare Zusammensetzung | ✓ | ✗ |
| Fluoreszenz | Konzentration der Fluorophore | ✓ | ✗ |
| Diffuse Reflexionsspektroskopie | Absorption & Streuung | ✓ | ✗ |
| OCT | Brechungsindex | ✗ | ✓ |
| Photoakustik | Absorption | ✗ | ✓ |
Für die multimodale optische Biopsie sind bisher nur wenige Ansätze bekannt. Am gebräuchlichsten ist eine Kombination aus Optischer Kohärenztomographie und Photoakustik (PA). Auch eine Kombination von OCT und Photoakustischer Mikroskopie (PAM) wurde untersucht, allerdings liefert letztere lediglich „En-Face-Bilder“ mit einer festen Tiefe, die nur schwer mit den üblichen 3D-OCT-Bildern vergleichbar sind. Darüber hinaus sind lange Messzeiten erforderlich, was im klinischen Alltag unpraktisch ist. Auch die Kombination von nichtscannender PA-Modalität und Ultraschall mit OCT ist nicht einfach, weil die optisch meist nicht transparenten US-Detektoren den direkten Lichtweg zur Läsion versperren. Solche PA-Messungen erfordern zudem den Aufbau eines Fabry-Perot-Interferometers und Scannen über Hautareale, was wieder zu langen Messzeiten und einer zu hohen, für In-vivo-Messungen unzulässigen Laserintensität führt.
Optische Biopsie der Haut
Vor kurzem haben wir, ein interdisziplinäres Team aus Physikern der Leibniz Universität Hannover und Medizinern der Universitätsmedizin Rostock, ein neuartiges System entwickelt. Es integriert vier verschiedene optische und akustische Modalitäten – Optische Kohärenztomographie, Photoakustische Tomographie (PAT), Raman-Spektroskopie (RS) (siehe „Optische und akustische Messmethoden für die Hautdiagnostik“ auf S. 9) und Ultraschall – in einem handhabbaren Scankopf und kann so erstmals alle notwendigen Informationen für eine objektive Diagnose liefern (Abbildung 1). Zu den größten Herausforderungen zählte die Integration der optischen und akustischen Modalitäten in einem Scankopf. Dies haben wir durch die Konstruktion eines transparenten akustischen Spiegels gelöst, der zur Ankopplung der PAT an die Haut in einem kleinen Wassertank (WT) eingebaut ist. Dadurch konnten die optischen und akustischen Modalitäten getrennt werden. Während der Messung wird der Wassertank auf die zu messende Stelle gelegt, dann wird eine geringe Wassermenge eingebracht. Das funktioniert auch an schwerer zugänglichen Körperstellen, denn auf der Untersuchungsliege lassen sich die Patienten immer passend positionieren.
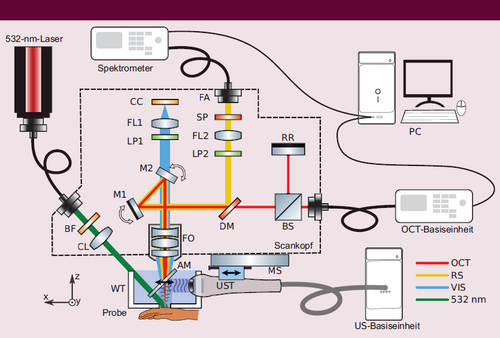
Das von uns entwickelte multimodale Messsystem. Die Linien stellen die optischen Pfade für OCT (rot), RS-Lichteinsammlung (gelb), Kamera (blau) und Anregungsstrahl für PAT/RS (grün) dar. Die einzelnen US/PAT-B-Mode-Bilder werden in der yz-Ebene aufgenommen, durch Verschieben des Ultraschallkopfs (US-Transducer, UST) in x-Richtung wird ein 3D-Bild erzeugt. AM: akustischer Spiegel; BF: Bandpassfilter; BS: Strahlteiler; CC: Kamerachip; CL: Kollimationslinse; DM: dichroitischer Spiegel; FA: Faseradapter; FL: Fokussierlinse; FO: Fokussierobjektiv; M1 und M2: bewegliche 2D-Galvospiegel; LP: Langpassfilter; MS: motorisierter Tisch; RR: Retroreflektor; SP: Kurzpassfilter WT: Wassertank (aus [3], adaptiert).
An der Basis des WT befindet sich eine quadratische 1 cm2 große Öffnung, die auf die Haut der Patienten gelegt wird. Der WT ist mit einem Frontfenster ausgestattet, durch das die optische Anregung für PAT und RS durchgeführt wird. Der Ultraschallkopf (Transducer, UST) mit dem Adapter wird im WT positioniert, der mit einer flexiblen Membran abgedichtet ist, welche die Bewegung des UST in x-Richtung ermöglicht. Der Wassertank und der UST-Adapter sind in Abbildung 2 dargestellt.

Links: 3D-Bild des US/PAT-Adapters, der auf der Haut positioniert wird, gezeigt ohne den Aufbau für Optische Kohärenztomographie und Raman-Spektroskopie (OCT/RS). Der Wassertank (WT) ist in der Mitte durchgeschnitten, um eine bessere Sicht zu ermöglichen. Rechts: Foto des Aufbaus für Ultraschall und Photoakustik US/PA, der unter der RS/OCT-Linse platziert wird (aus [4], adaptiert).
Typischerweise führen wir Untersuchungen von verdächtigen Hautläsionen wie folgt durch: Zunächst wird der UST zu einem Ende des WT gefahren, um die OCT/RS-Messungen zu ermöglichen. Dann wird der WT mit Wasser befüllt. Aufgrund der großen akustischen Impedanzabweichung zwischen Glas und Wasser fungiert ein Glasplättchen am UST-Adapter als akustischer Spiegel (AM), der sowohl die übertragenen als auch die gestreuten US/PAT-Wellen auf dieselbe WT-Öffnung reflektiert. Dadurch stellen wir sicher, dass die akustischen Messungen an der gleichen Position wie die OCT- und RS-Messungen durchgeführt werden.
Für die Erzeugung der 3D-Bilder wird der UST mit einem motorisierten Tisch innerhalb des WT verfahren. Zur optischen Anregung für PAT und RS verwenden wir eine Strahlquelle (zum Beispiel einen Optisch Parametrischen Oszillator, OPO), die 7-ns-Laserpulse mit einer Wiederholrate von 20 Hz erzeugt. Diese Pulse werden durch ein spezifisches optisches Faserbündel geführt und über zwei Kollimatoren und einen Diffusor auf die Hautläsion projiziert (grüner Pfad in Abbildung 1).
Die optischen Modalitäten OCT und RS (roter beziehungsweise gelber Pfad in Abbildung 1) werden in einem um ein RS-Sammelsystem erweiterten OCT-Sondenkopf (OCTP-900, Thorlabs) vereint. Der Spektralbereich des OCT-Signals mit zentraler Wellenlänge von 900 nm wird von der Basiseinheit (GAN621, Thorlabs) über eine Glasfaser übertragen, mit einem Galvoscanner-System (bewegliche Spiegel M1 und M2) gesteuert und mit einem Objektiv (FO) auf die Probe fokussiert. Der zweite Galvospiegel M2, der teilweise sichtbares Licht durchlässt, ermöglicht die Visualisierung der Probenebene durch eine CCD-Kamera (blauer Pfad in Abbildung 1). Mit Ultraschall steht uns eine zusätzliche akustische Modalität zur Tiefenmessung zur Verfügung, da das US-System nicht nur zur Detektion, sondern auch zur Erzeugung von Schallwellen geeignet ist.
Bei der Durchführung von In-vivo-Messungen am Menschen ist die Einhaltung der maximal zulässigen Exposition für Laserstrahlung (Maximum Permissible Exposure, MPE) vorgeschrieben. Die entsprechenden Vorschriften sind in Deutschland in dem Regelwerk TROS Teil 2 [3] festgelegt. Bei den Messungen werden abhängig von der Wellenlänge der eingesetzten Laserstrahlung, der Puls- beziehungsweise der Bestrahlungsdauer und der Integrationszeit maximale Bestrahlungsstärken von ≤ 6 mJ/cm2 pro Puls eingehalten.
(Opto-)Akustische Modalitäten (PAT und US)
Um das PAT/US-System zu charakterisieren, haben wir künstliche Modelle der Haut (Phantome) realisiert. Damit konnten wir das Signal-zu-Rausch-Verhältnis (Signal-to-Noise-Ratio, SNR) und die räumliche Auflösung von PAT und US testen. Das erste Phantom (Abbildung 3a) diente zur Messung der axialen Auflösung, also in Richtung der Lichteinstrahlung, und weist eine Stufenform auf. Für die Messung der lateralen Auflösung, senkrecht zur Lichteinstrahlung, verwendeten wir ein zweites Phantom (Abbildung 3b) mit mehreren Gitterstrukturen mit Perioden zwischen 100-800 μm. Dazu platzierten wir die Phantome in einem befüllten Wassertank und bestimmten die Auflösung als die kleinste unterscheidbare Gitterstufe.

Fotos von Agar-Phantomen für Tests der Auflösung und der PAT-Tiefenfähigkeit. a) Treppenförmiges Phantom mit verschiedenen Stufenhöhen; b) Phantom mit Rillen für seitliche Auflösungsmessungen; c) Würfel-Agar-Phantom mit Zahnseide in X-Form in verschiedenen Tiefen; d) „Kaffee-Treppen“-Agar-Phantom (aus [4], adaptiert).
Das Auflösungsvermögen bewerteten wir mit der sogenannten Sparrow-Grenze, die eine Schätzung der Winkelauflösungsgrenze eines optischen Instruments liefert. Dazu verwendeten wir das dritte Phantom (Abbildung 3c), das eine Würfelform mit Einkerbungen an der abgestuften, diagonalen Seite hat. Ein Faden aus Zahnseide ist in verschiedenen Tiefen (1-5 mm) kreuzförmig angeordnet. Unser Ziel ist es, den Punkt zu bestimmen, an dem ein Intensitätsabfall an der gekreuzten Stelle in der Tiefe auftritt. Dazu führten wir eine Folge von äquidistanten B-Mode-Messungen – also 2D-Schnitte durch das Phantom – in Schritten von 100 μm durch. Der Punkt, an dem der Intensitätsabfall erstmals auftritt, wird als die Auflösung in der entsprechenden Tiefe betrachtet.
Das letzte Phantom (Abbildung 3d) testet die Möglichkeiten der Tiefenmessung mit den US- und PAT-Modalitäten und besteht aus einer Kaffee-Agar-Mischung, die eine Hautläsion mit unterschiedlicher Tiefenausdehnung simuliert. Die Auflösung des Systems wurde mit <200 μm lateral und 100 μm axial für US sowie <300 μm lateral und <200 μm axial für PAT gemessen. Damit konnten wir SNR-Werte über 40 dB in Wasser und über 25 dB im Kaffee-Agar-Phantom sowie eine maximale Abbildungstiefe für beide Modalitäten von etwa 6 mm erreichen.
Optische Modalitäten (OCT und RS)
Die laterale und axiale Auflösung des OCT-Systems in Luft haben wir mit einem USAF-(U.S. Air Force)-Kalibriernormal zu 4 μm beziehungsweise 3 μm gemessen (Abbildung 4). Die Größe des RS-Lichtsammelpunkts betrug weniger als 300 μm (FWHM, Full Width at Half Maximum, Abbildung 5), was ausreichend ist, um ihn für die Raman-Messung auf kleinen Läsionen mit einem Durchmesser von < 1 mm zu positionieren. Darüber hinaus kann bei größeren Läsionen ein angemessenes Proben-Sampling erreicht werden. Für die RS haben wir zunächst tierische Proben aus Hühner- und Schweinehaut gewählt, die der menschlichen Haut sehr ähnlich sind. An verschiedenen Hautarealen gemessene Raman-Spektren ließen sich durch maschinelles Lernen klassifizieren. Die Klassifizierungsgenauigkeit durch sogenannte Support Vector Machine-(SVM)-Algorithmen oder künstliche neuronale Netze (CNN) lag bei fast 100 %. SVM-Algorithmen sind eine Variante des überwachten Maschinenlernens, die sich für eine Datenanalyse bei Klassifizierungs- und Regressionsaufgaben eignen.

OCT-Bild eines USAF-Kalibriertargets. Kleinste auflösbare Strukturen sind zirka 4 μm groß (gelber Pfeil) [10].
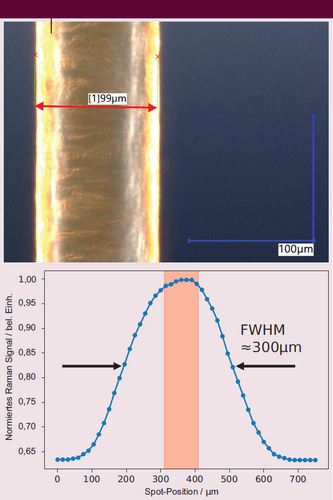
Größe des Raman-spektroskopischen Sammelspots, durch Scannen über ein rund 100 μm dickes Die Haar ermittelt. Die Halbwertsbreite (FWHM) des Spots beträgt etwa 300 μm (aus [3], adaptiert).
Die Proben konnten wir auch als Basis verwenden, um realistischere Hautphantome herzustellen. Dazu lösten wir synthetisches Melaninpulver in einer organischen Lösung (Dimethylsulfoxid, DMSO) als sogenanntes Eumelanin-Modell auf. Die tierischen Hautproben tauchten wir dann in die Melanin-DMSO-Lösung (M-DMSO) ein oder injizierten die M-DMSO-Lösung in die Epidermis der Proben. Auf diese Weise konnten wir Hautproben mit unterschiedlichem Melaningehalt realisieren. Damit untersuchten wir die Intensität typischer Raman-Signaturen der Haut, die charakteristisch für Proteine und Lipide sind: die sogenannten Amid-I-, CH2-Twist-, C-C-Streck- und CH2-Deformationsbanden. Eine maschinelle Lernmethode ließ sich auch hierbei einsetzen, um die Raman-Spektren dieser Hautphantome von den Spektren normaler, unbehandelter Haut mit einer Genauigkeit von zirka 90 % zu unterscheiden.
Weg bis zur klinischen Validierung
Für jedes System, das als Medizinprodukt konzipiert wird, stellt die Validierung im Rahmen von präklinischen oder klinischen Studien einen ersten entscheidenden Schritt dar. Wir haben das neue multimodale System in vivo an insgesamt 80 verdächtigen pigmentierten Hautläsionen bei Patienten der Universitätsmedizin Rostock eingesetzt. Ein entsprechendes Ethikvotum wurde eingeholt. Alle Arbeiten erfolgten nach Kriterien der Guten Klinischen Praxis (GCP: Good Clinical Practice) und der Deklaration von Helsinki. Die In-vivo-Messungen haben wir unterhalb der gesetzlich zulässigen Bestrahlungswerte (MPE) und mit Aufnahmezeiten von insgesamt unter 5 min pro Hautmerkmal durchgeführt. Beispiele für solche Messungen sind in den Abbildungen 6 und 7 dargestellt.
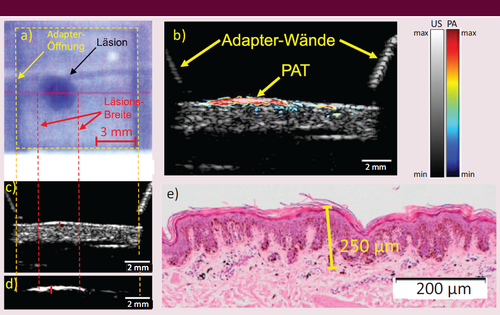
Messung an einem melanozytären Nävus (Muttermal). a) Kameraansicht der WT-Öffnung durch das optische Fenster. Die rosafarbene Linie quer über die Läsion markiert den in b) gezeigten B-Modus (2D-Schnitt). Die vorherrschende blaue Farbe im Kamerabild wird durch einen 475-nm-Kurzpassfilter verursacht, der für zusätzliche RS-Messungen erforderlich war. Vertikale gestrichelte Linien markieren die WT-Eröffnung (gelb) und die Breite der Läsion (rot). b) Kombinierte B-Moden-Aufnahme der Läsion. US ist in Graustufen dargestellt, PAT in Falschfarben. Diagonale Linien oberhalb der Haut stammen von den WT-Wänden. c) US-Bild und d) PAT-Bild in Graustufen. Durchgezogene rote Linien markieren die manuelle Messung der Läsionsdicke in der größten Tiefe. e) Entsprechende histologische Messung der entnommenen Probe, mit melanozytären Nävuszellen in einer maximalen Tiefe von 250 μm, gelbe Linie (aus [5], adaptiert).
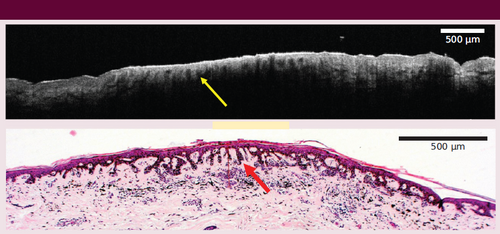
OCT-Bild eines Nävus mit einer Tumordicke von 250 μm. Oben: OCT-Scan. Unten: histologisches Bild. Die Pfeile zeigen die Reteleisten genannten Fortsätze der Epidermis, die auf beiden Bildern zu sehen sind (aus [5], adaptiert).
Für die Validierung erfolgte anschließend eine Exzision, also Entnahme einer Probe, bei der wir die Tumordicke histopathologisch ausgewertet haben. Durch Korrelation der gewonnenen Bilddaten mit den entsprechenden histologischen Befunden konnten wir dann die Genauigkeit und damit den potenziellen klinischen Nutzen unseres kombinierten Ansatzes für die nichtinvasive 3D-Bildgebung und Erkennung von Melanomen analysieren.
Die Ergebnisse der PAT- und US-Messungen zeigen eine sehr gute Übereinstimmung mit der histologischen Läsions- oder Tumordicke nach Breslow. Die PAT lieferte dabei bei einer Laserwellenlänge von 532 nm das beste Ergebnis. Diese Wellenlänge stellt daher einen guten Kompromiss zwischen Pulsenergie, optischer Absorption und Eindringtiefe ins Gewebe dar. Die genaueste Vorhersage der histologischen Invasionstiefe zeigt sich bei der Kombination der Ergebnisse von US und PAT. Die kombinierten Ergebnisse ergeben in der Regressionsanalyse einen vielversprechenden Bestimmtheitskoeffizienten (R2) von 0,97, was eine Verbesserung im Vergleich zu den einzelnen Modalitäten darstellt.
In Unterschied zu anderen Studien mit B-Moden-US und OCT, die aufgrund der teilweise begrenzten Eindringtiefe von OCT oder Hochfrequenzultraschall (HFUS) nur dünnere Läsionen < 1 mm analysierten, kann das neuartige multimodale System Läsionen in einem größeren Tiefenbereich (bis zu 4 mm) in vivo erfassen. Vorherige Studien erreichten lediglich Eindringtiefen von weniger als 2 mm bei niedrigerer Auflösung. Die beste Korrelation mit der histologischen Dicke zeigte das OCT-System. Es erreicht jedoch eine geringere Eindringtiefe von 0,5 mm aufgrund der hohen optischen Absorption und Streuung in stark pigmentierten Nävi und ist daher nur in der Lage, dünnere Läsionen aufzulösen. Die OCT-Bilder zeigen aber auch morphologische Merkmale der Haut, die bei der Klassifizierung sehr hilfreich sind (Abbildung 7). So können Merkmale der Epidermisstruktur wie die Reteleisten in ähnlichem Maße wie bei der Histologie aufgelöst werden. Im nächsten Schritt wollen wir mit einem größeren Datensatz ein tiefes neuronales Netzwerk trainieren. Ein Beispiel ist ein sogenanntes Convolutional Neural Network (CNN), eine vom visuellen Cortex inspirierte Variante künstlicher neuronaler Netze, die via Fehlerrückführung (Backpropagation) trainiert wird – eine Form des überwachten Lernens.
Bei der RS wurden die Messungen an verdächtigen Hautläsionen und den angrenzenden gesunden Bereichen durchgeführt. Die Fluoreszenz der Haut, die normalerweise bei der Aufbereitung der Spektren als Störgröße entfernt wird, blieb in den aufgenommenen Raman-Spektren erhalten. Insbesondere haben wir in der Fingerprint-Region der Raman-Spektren Änderungen des Fluoreszenz-Hintergrunds zwischen gesunder Haut, Muttermalen – sogenannten Nävi – und Melanomen sowie Änderungen der Intensität charakteristischer Hautkomponenten (Lipide und Proteine) beobachtet.
Verglichen mit gesunder Haut wiesen die Raman-Spektren von melanozytären Läsionen, einschließlich gutartiger Nävi und maligner Melanome, eine relativ geringe Intensität der Carotinoidbande auf, während die Intensitäten der Lipid- und Melaninbanden hoch waren. Daraus lässt sich schließen, dass melanozytäre Läsionen einen geringeren Carotinoidgehalt und einen höheren Lipid- und Melaningehalt als gesunde Haut aufweisen. Melanome unterscheiden sich zudem von den Nävi durch ihren höheren Melaningehalt. Allgemein stellte sich heraus, dass Melanome im Vergleich zu gesunder Haut durch eine geringere Fluoreszenzintensität im Fingerprint-Bereich (800-1800 cm−1) auffallen. Die Nävus-Proben zeigten eine Fluoreszenzintensität, die mit der von Melanomen am unteren Ende des Fingerprint-Bereichs vergleichbar war, jedoch allmählich im höheren Wellenzahlbereich zunahm und der Fluoreszenzintensität von gesunder Haut nahekam.
Das deutet darauf hin, dass es Unterschiede in der Art oder Konzentration der Fluorophore (z.B. Carotinoide, Lipofuszin und Melanin) in verschiedenen Hautproben gibt, die zu Unterschieden in der Autofluoreszenzintensität führen und als diagnostische Marker dienen können. Die Spektren wurden auch nach Entfernen der Autofluoreszenz analysiert, um etwa die spektralen Signaturen von Proteinen und Lipiden zu detektieren, deren Signalverhältnis ebenfalls diagnostisch relevant ist. Ein solches resultierendes Raman-Spektrum ist in Abbildung 8 dargestellt.
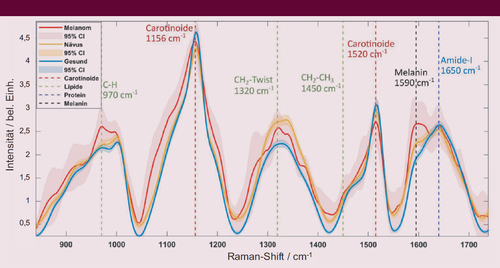
RS-Messung eines Nävus (gelb), Melanoms (rot) und gesunder Haut (blau) nach Nachbearbeitung und Entfernung der Fluoreszenz. Typische molekulare Signaturen der Haut (Carotinoide, Lipide, Proteine, Melanin) sind gestrichelt eingezeichnet. CI: Konfidenzintervall (aus [8], adaptiert).
Die gesammelten Raman-Daten eignen sich zur Klassifizierung, die mit den Spektraldaten einschließlich Fluoreszenz durch das SVM-Modell durchgeführt wurde. Die durchschnittliche Klassifizierungsgenauigkeit für die Unterscheidung von gesunder Haut, Nävus und Melanom betrug 90,2 % nach zehnfacher Kreuzvalidierung. Dies übertraf die Genauigkeit von 87,9 %, die mit Spektraldaten ohne Fluoreszenz erzielt wurde (Abbildung 9). Der ermittelte p-Wert misst die Wahrscheinlichkeit, die beobachteten Ergebnisse zu erzielen, wenn die Nullhypothese gilt, und war kleiner als 0,05, was auf statistische Signifikanz hinweist. Das zeigt folglich, dass der Fluoreszenzhintergrund im Raman-Spektrum wertvolle Informationen enthält, die für Algorithmen des maschinellen Lernens zugänglich sind, und dass die Verwendung von Raman-Spektren mit Fluoreszenz die Klassifizierungsgenauigkeit verbessern kann.
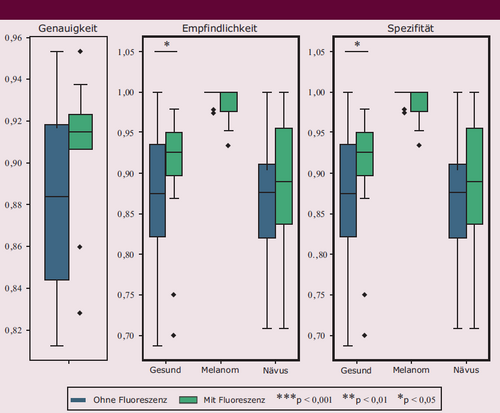
Boxplot zur Performanz des SVM-Modells bei der Klassifizierung von gesunder Haut, Nävi und Melanomen unter zwei verschiedenen Bedingungen mit zehnfacher Kreuzvalidierung. Gezeigt sind die erzielte Genauigkeit, Sensitivität und Spezifität für Spektren ohne und mit Fluoreszenzsignal (blau beziehungsweise grün) (aus [8], adaptiert).
Im klinischen Umfeld hat sich das neuartige System als wirksame, nichtinvasive In-vivo-Methode zur Messung und Bereitstellung von 3D-Tiefenbildern von Hautläsionen erwiesen. Der durchschnittliche Zeitaufwand je Läsion betrug unter 5 min für alle Modalitäten zusammen, die einzelnen Messungen benötigen wenige bis einige 10 s. Von medizinischer Seite besteht daher großes Interesse an einer solchen Messung, die nahezu in Echtzeit erfolgt und bei der Bestimmung der Exzisionsränder hilfreich ist. Der Vergleich der gemessenen und histologischen Werte ergab eine hohe Korrelation zwischen allen Modalitäten, insbesondere zwischen US, PAT mit 532 nm und OCT – letztere für dünne Läsionen < 0,5 mm. Bei allen Modalitäten wird eine leichte Überschätzung der Dicke beobachtet, die auf die Schrumpfung des Gewebes während der Exzision zurückgeführt wird. Die höchste Korrelation wurde durch die Mittelung der US und PAT gefunden, die ein vielversprechendes Bestimmtheitsmaß (R 2) von 0,97 ergab.
Das entwickelte System weist ein erhebliches Potenzial auf, die Hautkrebsdiagnose zu verbessern, weil es – als einziges System überhaupt – alle notwendigen Informationen durch eine schnelle, nichtinvasive Messung in vivo liefert, mehr Melanome in frühen Stadien erkennen kann und die Entscheidung über die Exzisionsränder unterstützt. Mit seiner neuartigen Integration von US-, PAT-, OCT- und RS-Modalitäten erreicht das System eine hohe Korrelation mit histopathologischen Standards und konnte auch im klinischen Umfeld erfolgreich getestet werden. Es steigert die Objektivität der Diagnose und lässt sich auch in der Telemedizin einsetzen.
So könnte in Zukunft nichtmedizinisches Personal die Untersuchungen am Patienten durchführen, und die Daten könnten nach KI-basierter Klassifizierung unter Sicherstellung der Datensicherheit visualisiert und den Dermatologen zur Verfügung gestellt werden. Zukünftig wird das System auch von weiteren Entwicklungen profitieren, etwa dem Einsatz eines leistungsfähigeren US-Erfassungssystems zur Erhöhung der Auflösung, der Implementierung der PAT-Beleuchtung aus zusätzlichen Winkeln zur Verbesserung der Bildgebung und der weiteren Integration künstlicher Intelligenz (KI) zur automatischen Segmentierung und Klassifizierung [6, 7]. Hinzu kommt eine Umwandlung der optischen in histologische Bilder, die von den Dermatologen ohne Zusatztraining sofort interpretiert werden können, sowie die Implementierung einer erklärbaren KI zur Erläuterung der Diagnose.
Optische und Akustische Messmethoden Für die Hautdiagnostik
Optische Kohärenztomographie (OCT)
OCT basiert auf Interferometrie mit Weißlicht oder breitbandigen Lichtquellen mit niedriger Kohärenz – alternativ mit abstimmbaren Lichtquellen. Die hier eingesetzte Spektraldomänen-(SD)-OCT nutzt die spektrale Information des Lichts, um das Tiefenprofil einer Probe aufzunehmen und ein 3D-Tomogramm zu rekonstruieren.
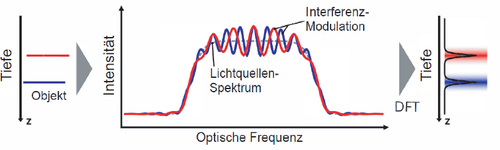
OCT-Signal im Frequenzbereich. Zwei dünne Grenzflächen (linkes Diagramm) werden in z-Richtung gemessen. Das Signal (mittleres Diagramm) ist eine Überlagerung von Intensitätsmodulationen (rote und blaue Kurve) der Quelle (graue gestrichelte Linie). Jede Reflexion in einer bestimmten Tiefe erzeugt eine Modulation mit entsprechender Frequenz. Daraus wird über eine diskrete Fourier-Transformation (DFT) das Tiefenprofil erzeugt (rechtes Diagramm) [9].
Photoakustische Tomographie (PAT)
Die Photoakustik beschreibt den Effekt der Erzeugung und Ausbreitung einer Schallwelle in einem absorbierenden Medium, das optisch beleuchtet wird.
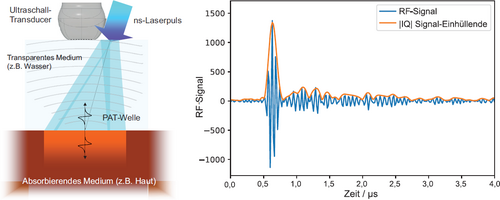
Links: Diagramm des PA-Prozesses zur Erzeugung einer Druckwelle in einer Probe. Durch die optische Bestrahlung wird thermische Energie eingebracht, die entsprechend dem Absorptionsprofil verteilt wird. Die Wärmeverteilung wird teilweise in Druck umgewandelt. Rechts: Typisches mit einem Ultraschallkopf (UST) aufgenommenes Hochfrequenz-Signal (RF) und Betrag des demodulierten Niederfrequenz-Signals (IQ), das zur Rekonstruktion der 3D-Tomogramme genutzt wird [10].
Raman-Spektroskopie (RS)
Der Raman-Effekt beruht auf der inelastischen Lichtstreuung an einer Probe. Das einfallende Photon induziert ein oszillierendes Dipolmoment in einem Molekül der Probe, wodurch ein Austausch von Energie zwischen Photon und Molekül stattfindet. Findet die Streuung an einem virtuellen Niveau statt, ist der Prozess sehr schwach und wird oft von der Fluoreszenz der Probe überlagert. Die als molekulare Fingerprint-Methode bekannte Technik gibt Aufschluss über deren chemische Zusammensetzung.
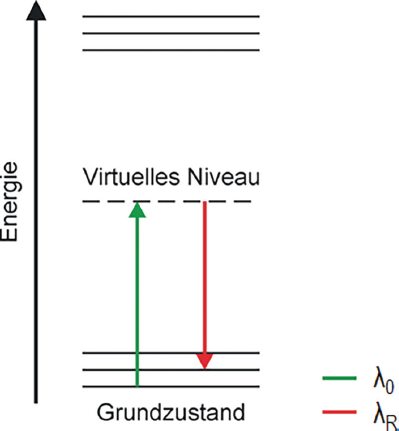
Energieschema der Raman-Streuung. Der Energieübertrag zwischen Photon λ0 und Molekül führt zu einer Verschiebung der Wellenlänge des gestreuten Lichts λR (Raman-Verschiebung), die als energetische Verschiebung relativ zur Energie des Anregungsphotons in „relativen Wellenzahlen“ (m−1= 0,01 cm−1) angegeben wird.
Wir erwarten, dass Fortschritte in diesen Bereichen die diagnostische Genauigkeit und die Benutzerfreundlichkeit des Systems weiter verbessern und zu wirksameren und weniger invasiven Hautkrebsbehandlungen beitragen können. Der Weg vom Labor zu einem Produkt ist allerdings noch weit und erfordert insbesondere die Durchführung von klinischen Studien sowie die Zertifizierung des Systems.
Danksagung
Die Autoren danken der Deutschen Forschungsgemeinschaft DFG für Förderung im Projekt RO 3471/18-1/, EM 63/13-1 sowie für Unterstützung im Rahmen der Deutschen Exzellenzstrategie im Exzellenzcluster PhoenixD (EXC 2122, Nummer 390833453).
Open-Access-Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Biographies

Team Hannover (v.l.n.r): Bernhard Roth promovierte in Physik an der Universität Bielefeld und ist heute Professor für Physik an der Leibniz Universität Hannover. Seine Hauptarbeitsgebiete umfassen Forschung in Optik und Photonik, die Realisierung und Integration funktionaler optischer Messsysteme und deren Transfer in Medizin und Lebenswissenschaften. Anatoly Fedorov Kukk promovierte an der Leibniz Universität Hannover. Sein Arbeitsgebiet umfasst die Entwicklung bildgebender Verfahren durch Photoakustik und Ultraschall, die Anwendung künstlicher Intelligenz sowie deren Einsatz in der Melanomdiagnostik. Di Wu promovierte an der Leibniz Universität Hannover. Seine Forschung umfasst die 3D-Bildgebung der Haut mittels OCT und Raman-Spektroskopie, die Datenanalyse mit maschinellem Lernen sowie die klinische Validierung.

Team Rostock (v.l.n.r): Rüdiger Panzer promovierte am Universitätsklinikum Schleswig-Holstein und ist heute Oberarzt an der Klinik und Poliklinik für Dermatologie und Venerologie des Universitätsklinikums Rostock. Seine Arbeitsgebiete liegen im Bereich Hautkrebs und seltene Hauterkrankungen. Steffen Emmert promovierte an der Universität Würzburg und ist heute Professor und Direktor der Klinik für Dermatologie und Venerologie in der Rostocker Universitätsklinik. Seine Arbeitsgebiete richten sich auf die genetische Analyse von Hautkrankheiten, die Bedeutung von Genvariationen für die Hautkanzerogenese und das therapeutische Ansprechen des malignen Melanoms.





