Federartiges Verhalten in [8]Helicendiimiden: Wie die Ganghöhe die optische Anisotropie und die elektronische Konjugation steuert
Kurzzusammenfassung
Mit ihrer schraubenförmigen Geometrie haben sich Helicene als prototypische molekulare Federn zur Entwicklung chiraler funktionaler Materialien durch präzise Strukturmodulation erwiesen. Hier stellen wir das Design und die Synthese von [8]Helicendiimiden ([8]HDIs) vor und zeigen, dass die Ganghöhe ihres Rückgrats durch Verbrückung der Imidstickstoffatome mit Alkylketten unterschiedlicher Länge (C3–C6) präzise eingestellt werden kann. Mit diesem Ansatz können die optische Anisotropie, das chiroptische Verhalten und die elektronische Kommunikation durch Restriktion der molekularen Geometrie systematisch kontrolliert werden. Bemerkenswerterweise führt die Modulation der Ganghöhe zu hohen optischen Dissymmetriefaktoren (bis zu 6.0 × 10−2) und verstärkter Konjugation durch den Raum. Weiterhin untersuchen wir, wie die Variation der Ganghöhe die Kristallpackung sowohl in enantiomerenreinen als auch in racemischen Proben beeinflusst. Ergänzende quantenchemische Berechnungen geben Aufschluss über den Ursprung dieser Eigenschaften und heben das Potential dieser Strategie für die Entwicklung fortgeschrittener chiraler Materialien hervor.
Einleitung
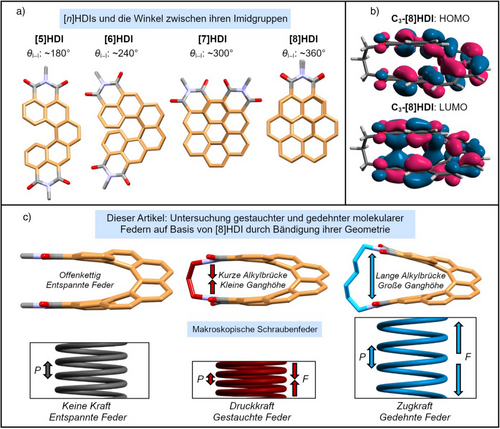
Dank ihres inhärent chiralen, vollständig konjugierten Rückgrats haben sich helicenartige Verbindungen[1-8] als vielversprechende funktionelle Moleküle herausgestellt. Dies liegt begründet in ihrem ausgeprägten Zirkulardichroismus (CD) und ihrer zirkular polarisierten Lumineszenz (CPL)[8-14] sowie ihrem Potential als Emitter für chirale Leuchtdioden (OLEDs),[15-18] in der asymmetrischen Katalyse,[19-22] und in aufstrebenden Themen wie der chiralitätsinduzierten Spinselektivität (CISS).[23, 24] In ihrer einfachsten Form bestehen Carbo[n]helicene aus n ≥ 5 ortho-verbundenen aromatischen Ringen,[25] welche sie in eine Schrauben- oder Korkenzieherform zwingen.[26] Damit stellen sie eines der einfachsten molekularen Analoga für eine klassische Schraubenfeder dar (Abbildung 1c). Dies ermöglicht es, sie als Modell für die Untersuchung federartigen Verhaltens auf dem molekularen Level einzusetzen.[27, 28] Ähnliche Systeme, oft als molekulare Federn bezeichnet,[29] unterliegen in letzter Zeit größerem Interesse, besonders in dem aufstrebenden Feld der molekularen Maschinen,[30-32] in dem helikale Strukturen eingesetzt werden, um eine strukturelle Reaktion auf externe Stimuli zu generieren.[33]
Während die Konzeption und Synthese federartiger Verbindungen vergleichsweise unkompliziert ist, stellt die Untersuchung ihrer elastischen Funktion und des Einflusses der Federspannung auf die makroskopischen Eigenschaften noch immer eine Herausforderung dar – obwohl verschiedene Methoden zur Erzeugung von strukturellen Veränderungen oder Spannung in federartigen Molekülen am Beispiel spezialisierter Systeme entwickelt worden sind. Beispielsweise konnten Petrukhina und Mitarbeiter (2021) die Ganghöhe eines doppelten [7]Helicens durch chemische Reduktion mit Kalium oder Rubidium von 2.09 Å auf 1.42 Å verringern.[35] Choudhury und Mitarbeiter erreichten ähnliche Ergebnisse durch den Einsatz von Säure oder Base als Stimulus sowie einem am helikalen Rückgrat angebrachten Ringschluss-Fotoschalter.[36] Neben chemischen Stimuli kann auch mechanische Kompression zur Kontraktion molekularer Federn eingesetzt werden. Müllen und Mitarbeiter untersuchten kürzlich die Fluoreszenz zweier π–erweiterter [n]Helicene, während sie einem Druck von bis zu 6 GPa in einer Diamantstempelzelle ausgesetzt wurden.[37] Es zeigte sich, dass höherer Druck zu Fluoreszenzlöschung und einer signifikanten Rotverschiebung des Restsignals führte – wahrscheinlich verursacht durch die Stauchung der Schraubenfeder. Da diese Hochdruckexperimente jedoch nur mit racemischen Proben durchgeführt wurden, konnte der Einfluss auf die chiroptischen Eigenschaften nicht untersucht werden.
Zwar stellt ein Ansprechen auf externe Stimuli eine unabdingbare Eigenschaft in der Suche nach molekularen Maschinen dar, jedoch sind die auf diese Weise induzierten strukturellen Veränderungen reversibel und beeinflussen die elektronischen Eigenschaften und das Redoxverhalten der Verbindungen. Dies macht es anspruchsvoll, den Einfluss der durch die Stimuli verursachten Stauchung oder Dehnung der Feder auf die molekularen Eigenschaften zu quantifizieren. Diese Hürde kann überwunden werden, indem die Ganghöhe der molekularen Federn durch Modifikation der Struktur kontrolliert wird, entweder durch die Einführung sterisch anspruchsvoller Substituenten – etwa am inneren Rand π–erweiterter Helicene–[38] oder durch den Einbau von Brücken oder „Spanngurten“ in das Molekül, die das π-konjugierte System in eine gespannte Form zwingen. Letztere Strategie wurde erfolgreich eingesetzt um die Geometrie von Molekülen wie Pyrenen[39] und Teropyrenen,[40] Perylendiimiden[41] und anderen π-konjugierten Verbindungen[42-46] zu verzerren. Im Jahr 2002 wandten Tanaka und Mitarbeiter eine Brückenstrategie an, um die Ganghöhe von [7]Thiaheterohelicenen zu kontrollieren und zeigten, dass eine größere Ganghöhe zu stärkeren CD-Signalen führte.[47] Cuerva und Mitarbeiter untersuchten in einer Reihe von Veröffentlichungen, wie o-Phenylen-Ethylen-Oligomere in helikal chiralen Konformeren fixiert werden können, indem ihre Enden mit Etherbrücken zusammengeheftet werden.[48-51] Durch die Anwendung dieser Strategie erhielten sie Verbindungen mit bemerkenswerten Lumineszenz-Dissymmetriefaktoren (glum) von bis zu 5.5 × 10−2.[49] Ebenso konnten sie eine reversible Modulation der CPL-Emission als Antwort auf Komplexbildung mit Ag(I)-Kationen demonstrieren.[48, 50] Vor kurzer Zeit erreichten Gidron und Mitarbeiter[52] eine präzise Kontrolle über den Steigungswinkel von S-förmigen doppelten [4]Helicenen, indem die beiden Enden der Moleküle durch Alkylketten verschiedener Länge verbunden wurden. In diesem Fall führte ein größerer Steigungswinkel der Helix zu kleineren Fluoreszenzquantenausbeuten (FQYs) und niedrigeren Fluoreszenzlebensdauern, während die molare Elliptizität der energetisch niedrigsten elektronischen Übergänge anstieg. Moya und Mitarbeiter untersuchten die Anpassung der Ganghöhe chiraler Bodipy-Dimere durch sterisch anspruchsvolle Substituenten, was ebenfalls zu einem starken Anstieg von glum mit größerer Ganghöhe führte.[53] Diese Ergebnisse zeigen, dass schon marginale strukturelle Veränderungen einen erheblichen Einfluss auf die chiroptischen Eigenschaften der Verbindungen haben können.
Jüngste Arbeiten von Crassous, Zysman-Colman und Mitarbeitern heben eine ähnliche Beobachtung hervor: Unvorhergesehene Verzerrung in der Struktur ihres multiresonanten Dreifach-Helicens führte zu einem gemessenen glum von 6.8 × 10−4 im Gegensatz zum berechneten Wert von 2.1 × 10−2 für die ideale C3-symmetrische Struktur.[54] Im Einklang damit legen theoretische Untersuchungen nahe, dass die chiroptischen Eigenschaften[55] und der Elektronentransport[56] von Helicenen durch Kontrolle ihrer Ganghöhe eingestellt werden können.
Trotz der in den zitierten Arbeiten gewonnenen Einblicke wurde eine umfassende Untersuchung des Einflusses der präzisen Kontrolle der Ganghöhe helicenbasierter molekularer Federn auf deren Kristallpackung sowie ihre optischen, chiroptischen und elektrochemischen Eigenschaften bisher nicht erreicht.
Vor Kurzem haben wir eine neue Kategorie zweifach imidsubstituierter[7, 57-64] Carbo[n]helicene ([n]Helicendiimide, [n]HDIs, n = 5–7, Abbildung 1a) eingeführt und gezeigt, dass ihre chiroptischen und elektrochemischen Eigenschaften durch Veränderung der Länge ihres Rückgrats[34] sowie durch Anpassung des Chromophors durch die Einführung funktioneller Gruppen an der äußeren Helix zur Schaffung eines elektronischen Donor-Akzeptor-Systems gesteuert werden können.[65] Dieser Artikel befasst sich mit dem höheren Homolog dieser Reihe, [8]HDI, in welchem das die Imidgruppen tragende aromatische System eine komplette Umdrehung vollzieht, so dass die beiden funktionellen Gruppen direkt übereinander angeordnet sind (Abbildung 1a). Diese räumliche Nähe ließ uns ungewöhnliche Eigenschaften erwarten, die durch die starke Wechselwirkung durch den Raum[66, 67] zwischen den gegenüberliegenden Enden des Moleküls verursacht werden (Abbildung 1b). Die geeignete räumliche Nähe der beiden Imid-Stickstoffatome ermöglicht es auch, sie mit Alkylketten unterschiedlicher Länge zu verbinden, was zu vier verbrückten [8]HDIs, Cm-[8]HDI (m = 3–6, Schema 1) führt, anhand derer die Auswirkungen von Stauchung und Dehnung des molekularen Rückgrats demonstriert werden können (Abbildung 1c). Als Referenz und zum leichteren Vergleich mit unseren zuvor synthetisierten Verbindungen wurden ebenfalls drei offenkettige [8]HDIs (N-nBu-[8]HDI-f-OMe, N-nBu-[8]HDI und N-Me-[8]HDI) dargestellt. Anhand experimenteller Ergebnisse und theoretischer Berechnungen konnten wir zeigen, dass die Ganghöhe P die Kristallpackung, die optischen und chiroptischen Eigenschaften, sowie die Redoxchemie dieser Verbindungen bestimmt. Insbesondere werden die Absorptions- und Emissionsdissymmetriefaktoren (gabs und glum) durch Verringerung der Ganghöhe deutlich verbessert.
Ergebnisse und Diskussion
Synthese und Charakterisierung
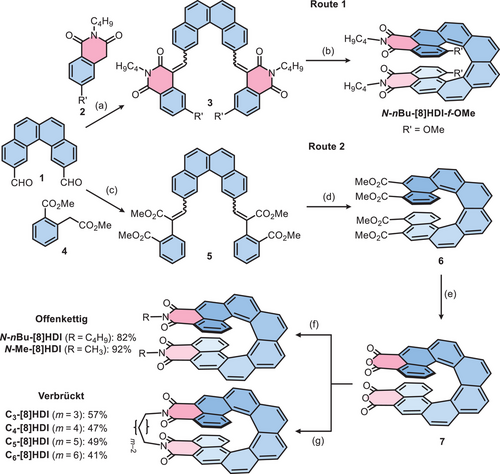
Wir haben zuvor die zweistufige Synthese fjord-methoxysubstitutierter [n]HDIs (n = 5–7) durch Einsatz einer bausteinbasierten Strategie etabliert: (1) Kopplung des Homophthalimid-Derivats 2 mit aromatischen Dialdehyden in einer Knoevenagel-Reaktion zur Bildung stilbenartiger Vorstufen, gefolgt von (2) Mallory-Photocyclodehydrogenierung (PCD), um die [n]HDIs (n = 5–7) zu erhalten.[34, 65] Diese Herangehensweise wurde als Startpunkt zur Synthese der [8]HDIs genutzt (Route 1, Schema 1). Die erste Herausforderung stellte die Gewinnung des [4]Helicen-Dialdehyds 1 dar. Diese Verbindung war zwar bekannt, die einzige Referenz, in der sie erwähnt wurde, enthielt jedoch keine synthetischen Einzelheiten.[68] Wir optimierten daher eine Synthesestrategie ausgehend von 2,7-Dibromnaphthalin, um 1 über vier Schritte mit 56 % Gesamtausbeute zu erhalten (Abschnitt S2). Wir stießen allerdings auf Probleme mit der PCD-Reaktion beim Versuch, N-nBu-[8]HDI-f-OMe darzustellen. Während die Vorstufe 3 mit 44 % Ausbeute erhalten wurde, konnte in der PCD-Reaktion auch nach mehreren Tagen lediglich eine Ausbeute von 8 % erzielt werden.
Wir entwickelten daher einen alternativen Syntheseweg (Route 2, Schema 1). Dabei lag der entscheidende Unterschied in der Verwendung von Homophthalsäuredimethylester (4) an Stelle von 2 in der Knoevenagel-Reaktion. Daraufhin folgte die Umsetzung des aus der PCD-Reaktion resultierenden [8]Helicentetracarboxylatesters 6 in das [8]Helicen-Dianhydrid 7 mittels eines Überschusses an p-Toluolsulfonsäure-Monohydrat. Anschließend wurde 7 mit dem geeigneten Amin umgesetzt, um die gewünschten [8]HDIs zu erhalten. Entscheidend ist hierbei, dass die PCD-Reaktion von 5 zu 6 in wesentlich größerer Menge (in der Größenordnung von einigen hundert Milligramm), kürzerer Reaktionsdauer (24 h) und mit deutlich größerer Ausbeute (∼50 %) möglich ist, was wahrscheinlich auf die elektronenreichere Natur von 6 verglichen mit 3 zurückzuführen ist.[57, 69] Obwohl dieser Weg mehr Stufen als Route 1 benötigt, ist er vielseitiger. Die Enantiomerentrennung mittels HPLC unter Verwendung einer Säule mit chiraler stationärer Phase (CSP) kann mit 6 durchgeführt werden und muss nicht für jede neue Endverbindung optimiert werden. Darüber hinaus kann das Dianhydrid 7 als Ausgangspunkt für eine Vielfalt von Zielmolekülen dienen – auf die gleiche Weise wie die umfangreiche Chemie, die für Rylendiimide ausgehend von deren Anhydriden entwickelt wurde.[70-72]
Während die offenkettigen Dialkyl-[8]HDIs (N-nBu-[8]HDI und N-Me-[8]HDI), welche als Referenzverbindungen dienen, in guten Ausbeuten über einfache Reaktion mit einem Überschuss an Amin in Propansäure erhalten wurden, war für die Synthese der alkylverbrückten [8]HDIs (Cm-[8]HDI, m = 3–6) eine sorgfältige Abstimmung der Reaktionsbedingungen nötig. Der Ringschluss ist zwar kinetisch begünstigt, doch die zahlreichen möglichen Nebenreaktionen, einschließlich Oligomerisierung oder Reaktion mit zwei Äquivalenten Amin, machten die Optimierung der Reaktionsbedingungen anspruchsvoll. Durch das Hochverdünnungsprinzip von Ziegler und Ruggli,[73] das durch die langsame Zugabe von einem Äquivalent des jeweiligen Diamins und einer Konzentration des Anhydrids von ∼ 2 × 10−4 m in Toluol mit Imidazol und Pyridin als Co-Lösungsmittel erreicht wurde, konnte Cm-[8]HDI (m = 3–6) jedoch in Ausbeuten zwischen 41 % und 57 % dargestellt werden. 6 wurde mittels HPLC auf einer semipräparativen CSP-Säule in seine Enantiomere aufgetrennt (Abbildung S19, Tabelle S6). Die Reaktionen mit enantiomerenreinem 6 lieferten ähnliche Ausbeuten für die Imidisierung wie die mit rac-6. Die Enantiomerenreinheit der Produkte wurde durch analytische CSP-HPLC sichergestellt. Dank der großen kinetischen Stabilität von [8]Helicenen[6, 74] fand während der Reaktionen keine Racemisierung statt. Die Strukturen der erhaltenen Verbindungen wurden durch 1D und 2D 1H- und 13C-NMR-Messungen, (Abschnitt S8), hochauflösende Massenspektrometrie (Abschnitt S9) und Röntgenkristallstrukturanalyse (Abschnitt S7) eindeutig bestätigt.
Effekt der Ganghöhe auf die Festphasenstrukturen und die Molekularpackung
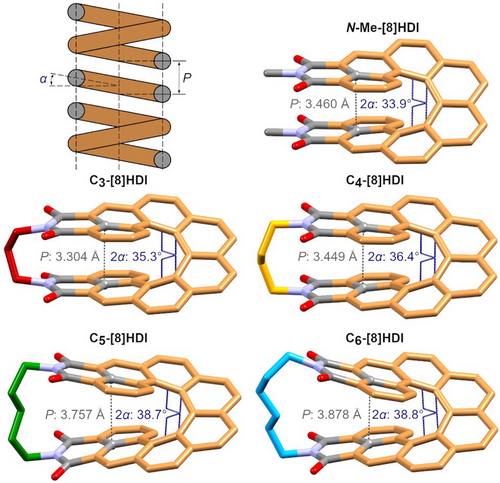
Die Auswirkung der verschiedenen Alkylbrücken auf die Ganghöhe und damit einhergehend die Molekülpackung wurde durch Röntgenkristallographie untersucht. Einkristalle von allen racemischen [8]HDIs sowie von enantiomerenreinem C3-[8]HDI, C4-[8]HDI und N-Me-[8]HDI wurden durch verschiedene Diffusions- und Verdampfungsmethoden gezüchtet (Abschnitt S7). Die erwarteten Strukturen wurden bestätigt und der starke Einfluss der Länge der Alkylbrücke auf das helikale Rückgrat wurde deutlich gemacht.
Die grundlegenden Parameter, die die Geometrie einer klassischen Schraubenfeder definieren – die Ganghöhe P und der Gangwinkel α – besitzen direkte Äquivalente, die in den entsprechenden Kristallstrukturen gemessen werden können (Abbildung 2). Die Ganghöhe kann durch den Abstand zwischen den Kohlenstoffatomen an der Schnittstelle zwischen dem [8]Helicen und dem Imidring (dC–C) und 2α durch den Torsionswinkel zwischen der dritten und sechsten Kohlenstoff-Kohlenstoff-Bindung innerhalb der inneren Helix des Rückgrats angenähert werden. dC–C nimmt von 3.304 Å in C3-[8]HDI auf 3.878 Å in C6-[8]HDI zu und 2α steigt von 35.3° auf 38.8°. Bemerkenswerterweise ist der Wert von 33.9° für 2α in N-Me-[8]HDI niedriger als der aller verbrückter [8]HDIs, was wahrscheinlich auf die starken intermolekularen Dipol-Dipol-Wechselwirkungen zwischen den Imidgruppen in der Kristallstruktur zurückzuführen ist – die DFT-optimierte Struktur weist mit 38.2° den erwarteten dazwischenliegenden Wert auf (Tabelle S17). Wie wir vermuteten, kann die Ganghöhe von [8]HDI also durch Variation der Brückenlänge in verschiedenen gestauchten oder gedehnten Zuständen fixiert werden. Die experimentellen Werte für dC–C korrelieren gut mit den aus DFT-Berechnungen gewonnenen Werten. Ein drittes Merkmal, welches sich nur in den [8]HDIs wiederfindet, ist der Diederwinkel zwischen den durch die Imidringen aufgespannten Ebenen, der ein Maß für die Verzerrung der Struktur durch die verbrückende Alkylkette darstellt (Abbildung S32). Während die Ebenen der Imidringe in C6-[8]HDI mit einem signifikanten Winkel von 26.2° auseinandergedrückt werden, zeigen sie in C3-[8]HDI in einem Winkel von −4.1° aufeinander zu. Diese Änderungen der Gesamtgeometrie haben erhebliche Auswirkungen auf die Kristallpackungsmuster (Abbildung S34).
Die Kristallpackungen von rac-C3- und rac-C4-[8]HDI bestehen aus alternierenden homochiralen säulenartigen Stapeln mit teilweise ineinandergreifenden Rückgraten der (P)- und (M)-Enantiomere, die hauptsächlich durch π–π-Wechselwirkungen zusammengehalten werden. Eine vergleichbare Anordnung ist in zwei Polymorphen von rac-N-Me-[8]HDI zu finden. In rac-C5-[8]HDI-Kristallen ändert sich diese Anordnung zu Stapeln von alternierenden (P)- und (M)-Enantiomeren. rac-C6-[8]HDI bildet ähnlich wie rac-C3- and rac-C4-[8]HDI homochirale Säulen aus, allerdings sind dabei die einzelnen Moleküle in den Stapeln um 180° zueinander versetzt. Das längerkettige rac-N-nBu-[8]HDI weist aufgrund des größeren von den Alkylketten eingenommenen Volumens eine komplizierte Anordnung auf. Die enantiomerenreinen Verbindungen zeigen im Vergleich mit den racemischen Gegenstücken eine andere Kristallpackung. Im Fall von (M)-C3-[8]HDI besteht der Kristall aus homochiralen Stapeln, in denen jedes gestapelte Molekül um 90° in entgegengesetzter Richtung zum helikalen Rückgrat gedreht ist, während die einzelnen Moleküle innerhalb der säulenartigen Strukturen bei (M)-C4-[8]HDI alle parallel ausgerichtet sind, aber jede Säule um 90° bezogen auf ihre Nachbarn gedreht ist. (P)-N-Me-[8]HDI weist eine Fischgrätenmuster-artige Packung auf, die aus Ebenen ausgerichteter Moleküle besteht. Im Gegensatz zu einem echten Fischgrätenmuster gibt es jedoch nicht nur zwei, sondern vier verschiedene Orientierungen, die sich im Kristall wiederholen.
Effekt der Ganghöhe auf die optischen Eigenschaften
Die Zielverbindungen wurden alle als kristalline, hellgelbe Feststoffe erhalten, die in Lösung eine grünliche Fluoreszenz zeigen. Ihre Absorptionsspektren werden nur wenig von der Ganghöhe beeinflusst – mit Ausnahme einer Verschiebung des schwachen ersten Absorptionsmaximums in Richtung längerer Wellenlängen mit kleinerer Ganghöhe (Abbildung 3a). Das erste Absorptionsmaximum um 460 bis 475 nm ist von kleinem Ausmaß, mit Extinktionskoeffizienten zwischen 1200 m−1 cm−1 für C3- und C4-[8]HDI und 1600 m−1 cm−1 für C5- und C6-[8]HDI (in Toluol), wobei die offenkettigen Analoga dazwischen liegen (Tabelle 1, Tabelle-S1).

| Verbindung | P/Å | λabs/nma) | λem/nmb) |
ϕFL/% |
τFL/ns | Eg/eVc) | |gabs| ×102d) | |glum| ×102e) | LUMOe/eV | HOMOf)/eV | V12g) cm−1 | ΔEredh)/eV |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| C3-[8]HDI | 3.304 | 477 | 495 | 5.8 | 6.96 | 2.56 | 5.6 | 6.0 | −3.52 | −6.06 | 1902 | 0.30 |
| C4-[8]HDI | 3.449 | 471 | 487 | 5.7 | 6.52 | 2.60 | 5.1 | 5.3 | −3.50 | −6.08 | 1458 | 0.27 |
| C5-[8]HDI | 3.757 | 464 | 474 | 5.7 | 6.11 | 2.65 | 4.0 | 4.0 | −3.39 | −6.03 | 985 | 0.27 |
| C6-[8]HDI | 3.878 | 463 | 472 | 6.5 | 6.20 | 2.66 | 3.5 | 3.3 | −3.36 | −6.00 | 922 | 0.26 |
| N-Me-[8]HDI | 3.460 | 468 | 480 | 4.3 | 5.72 | 2.63 | 3.1 | 3.4 | −3.47 | −6.09 | 658 | 0.23 |
| N-nBu-[8]HDI | 3.529 | 466 | 479 | 5.6 | 5.97 | 2.63 | 3.1 | – | −3.39 | −6.03 | 749 | 0.23 |
- a) Aufgrund der niedrigen Extinktionskoeffizienten für die energetisch niedrigsten Übergänge wurden deren Wellenlängen durch das erste lokale Minimum in der zweiten Ableitung der Absorptionsspektren bestimmt.
- b) Emissionsmaximum nach Anregung bei 350 nm.
- c) Die optischen Energielücken wurden anhand des Schnittpunkts der normalisierten Absorptions- und Emissionsspektren berechnet.
- d) Angegeben sind die maximalen Dissymmetriefaktoren.
- e) LUMO = − (5.1 + Ered1).[75]
- f) HOMO = LUMO – Eg.
- g) Berechnete elektronische Kopplung zwischen den Redoxzentren (Tabelle S10).
- h) Differenz zwischen den Reduktionspotentialen der beiden Imidgruppen. –: Nicht gemessen.
Im Gegensatz dazu hat die Ganghöhe des Rückgrats einen großen Einfluss auf die Emissionsspektren. Obwohl alle Verbindungen ein ähnliches Emissionsprofil aufweisen (Abbildung 3b), zeigt sich eine bemerkenswerte bathochrome Verschiebung mit abnehmender Ganghöhe. Dies kann durch eine selektive Stabilisierung des LUMO durch Wechselwirkungen durch den Raum zwischen den Imidgruppen und daraus folgend eine kleinere optische Energielücke erklärt werden (Tabelle 1, Tabelle S5). Die nicht verbrückten Referenzverbindungen (N-Me-[8]HDI und N-nBu-[8]HDI) zeigen ähnliche Absorptions- und Emissionsprofile mit Emissionsmaxima bei 480 bzw. 479 nm, was auf einen vernachlässigbaren Einfluss der Länge der Alkylketten auf die optischen Spektren hinweist. Die bathochrome Verschiebung von C3- und C4-[8]HDI sowie die hypsochrome Verschiebung von C5- und C6-[8]HDI im Vergleich zu diesen Referenzverbindungen lassen sich daher ausschließlich auf die Stauchung oder Dehnung der molekularen Feder durch die Alkylbrücken zurückführen. Die ähnlichen vibronischen Strukturen der Emissionsspektren aller Verbindungen deuten darauf hin, dass die Steifigkeit des Fluorophors trotz der großen strukturellen Veränderungen nur schwach von der Ganghöhe abhängt.
Während sich in den Absorptionsspektren keine ausgeprägten Lösungsmitteleffekte zeigen, ist bei allen Verbindungen eine deutliche bathochrome Verschiebung der Fluoreszenz in der Reihe Toluol – Chloroform – THF – DMSO zu beobachten (Abschnitt S3.2). In Toluol ist eine deutliche vibronische Struktur in den Emissionsspektren zu erkennen, während die Merkmale der Spektren im polaren DMSO größtenteils durch Linienverbreiterung verdeckt werden.
Die Fluoreszenzquantenausbeuten aller Verbindungen liegen bei etwa 0.05 und die Fluoreszenzlebensdauern zwischen 5 und 7 ns. Daher sind die Geschwindigkeitskonstanten sowohl für die strahlenden als auch für die nichtstrahlenden Prozesse in allen Verbindungen ähnlich (Tabelle 1, Tabellen S1–S4). Im Gegensatz zu früheren Studien über die Auswirkungen von sterischer Spannung auf federartige Helicene[52, 76, 77] führen die Veränderungen der Ganghöhe des molekularen Rückgrats bei den [8]HDIs zu keiner nennenswerten Fluoreszenzlöschung oder Beschleunigung der nichtstrahlenden Zerfallsmodi.
TD-DFT-Rechnungen (B3LYP/6-311G(2d,p)//ωB97XD/6-31g(d,p)) liefern weitere Erkenntnisse über die elektronischen Übergänge, die für die Absorptionsspektren verantwortlich sind. Bei den C3-, C4- und C5-verbrückten [8]HDIs setzt sich der energetisch niedrigste elektronische Übergang größtenteils aus dem HOMO→LUMO-Übergang mit relativ niedrigen Oszillatorstärken von 0.015 bis 0.018 zusammen, was mit den niedrigen Extinktionskoeffizienten der beobachteten Absorptionspeaks übereinstimmt (Tabelle S9). Im Gegensatz dazu zeigt derselbe Übergang für C6-[8]HDI sowie für die nicht-verbrückten [8]HDIs einen signifikanten Beitrag des HOMO−1→LUMO-Übergangs mit ähnlichen Oszillatorstärken (außer für C6-[8]HDI, welches f = 0.029 aufweist). In diesem Zusammenhang ist es bemerkenswert, dass das HOMO und das HOMO+1 in allen Verbindungen nahezu entartet sind, während der energetische Unterschied zwischen dem LUMO und dem LUMO+1 mit der Länge der verbrückenden Alkylkette abnimmt.
Effekt der Ganghöhe auf die chiroptischen Eigenschaften
Die enantiomerenreinen [8]HDIs zeigen eine ausgeprägte chiroptische Antwort (Abbildung 4). Ihre absoluten Konfigurationen wurden durch Vergleich der experimentellen und der berechneten CD-Spektren bestimmt. Zusätzlich konnten die absoluten Konfigurationen von (M)-C3-[8]HDI, (M)-C4-[8]HDI und (P)-N-Me-[8]HDI durch den Flack-Parameter in ihren Kristallstrukturen bestätigt werden. Die experimentellen und die berechneten Spektren stimmen größtenteils überein (Abbildungen S21–S22). Die CD-Spektren weisen drei Hauptpeaks im sichtbaren und Nah-UV-Bereich des Spektrums auf. Der zweite dieser Peaks erreicht beträchtliche Δε-Werte von 90 m−1 cm−1 für C3-[8]HDI bis 170 m−1 cm−1 für C6-[8]HDI, während der erste Peak (450–500 nm) mit dem energetisch niedrigsten Absorptionspeak übereinstimmt und etwas geringere Δε-Werte aufweist. Mit abnehmender Ganghöhe nimmt die Rotationsstärke des ersten Peaks zu, während die des zweiten und dritten Peaks abnimmt. Gleichzeitig weisen die niederenergetischen Übergänge in den Absorptionsspektren deutlich niedrigere Extinktionskoeffizienten auf, was auf einen hohen gabs-Faktor hindeutet. In der Tat zeigen alle [8]HDIs ihre maximalen gabs-Werte in der Nähe des ersten Peaks im CD-Spektrum. Diese Werte reichen von 3.1 × 10−2 für die offenkettigen N-Me- and N-nBu-[8]HDI – ähnlich dem ursprünglichen [8]Helicen[78, 79] – bis hin zu 5.6 × 10−2 in C3-[8]HDI. Sie sind in Lösungsmitteln verschiedener Polarität ähnlich (Tabellen S1–S4). Die Korrelation zwischen Ganghöhe und gabs ergibt eine fast perfekt lineare Beziehung für die verbrückten Verbindungen, während die offenkettigen [8]HDIs Ausreißer auf der niedrigen Seite darstellen (Abbildung 4c). Bemerkenswerterweise sind die Kurvenformen und gabs-Werte für Wellenlängen unter 450 nm in allen getesteten Lösungsmitteln und für alle Verbindungen ähnlich, was darauf hindeutet, dass der energetisch niedrigste Übergang der Einzige ist, der von den Geometrieänderungen beeinflusst wird (Abbildungen S11, S13–S15).
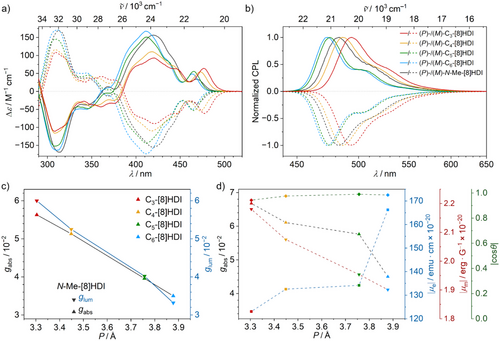
Die CPL-Spektren der [8]HDIs weisen ähnliche Merkmale wie ihre Fluoreszenzspektren auf, wenn auch mit einer weniger ausgeprägten vibronischen Struktur, da die niederenergetischen Banden im Vergleich zu den Fluoreszenzspektren ein verhältnismäßig kleineres CPL-Signal aufweisen (Abbildung 4b). Im Einklang damit erreichen die glum-Plots ihre jeweiligen Maxima für sämtliche Verbindungen nahe dem jeweiligen Emissionspeak. Die glum-Werte reichen von 3.1 × 10−2 für C6-[8]HDI bis 6.0 × 10−2 für C3-[8]HDI und zeigen wie die gabs-Werte einen linearen Zusammenhang mit der Ganghöhe. Ein ähnlicher linearer Zusammenhang zwischen Ganghöhe und Dissymmetriefaktoren wurde zuvor in helikalen Bodipy-Dimeren beobachtet–[53] in diesem Fall korrelierten bessere Eigenschaften jedoch mit einer Zunahme der Ganghöhe, während sie in den Cm-[8]HDIs mit sinkender Ganghöhe verknüpft sind. Auch hierbei befindet sich das offenkettige N-Me-[8]HDI mit einem deutlich niedrigeren Wert in einer Ausreißerposition (Abbildung 4c). Die glum-Plots zeigen eine klare Peakstruktur (Abbildungen S11, S13–S15), was ungewöhnlich ist, da die meisten Verbindungen nahezu konstante glum-Werte über die gesamte Breite des Emissionsspektrums aufweisen.[80] Zusammen mit den ähnlich großen gabs-Fakoren sind diese Werte unter den besten, die je für helicenartige Verbindungen verzeichnet wurden[8, 10, 11, 81-89] und werden unter rein organischen Verbindungen nur von wenigen chiralen Kohlenstoffnanoröhren-Wandsegmenten[90] und ähnlichen Molekülen mit Zylinderchiralität[91, 92] sowie einigen selbstorganisierten Makrozyklen[93] übertroffen. Die ähnlichen Werte von gabs und glum deuten darauf hin, dass trotz der großen Überlappung der Enden des Helicenrückgrats und der Imidgruppen keine Excimerbildung stattfindet.[94] Während von Helicenen abgeleitete Moleküle in der Regel deutlich niedrigere glum-Werte im Vergleich mit den gabs-Werten aufweisen,[10, 80] zeigen die diskutierten Verbindungen fast identische Werte, was auf sehr geringe strukturelle Reorganisation im angeregten Zustand schließen lässt.
Um den Einfluss der Ganghöhe auf die chiroptischen Eigenschaften zu erhellen, wurden unterstützende TD-DFT-Berechnungen durchgeführt, um die Werte für die elektrischen (µe) und magnetischen (µm) Übergangsdipolmomente für die S0→S1- und S1→S0-Übergänge zu erhalten (Tabellen S8.1, S8.2), da sich die g-Werte aus dem Zusammenspiel dieser Faktoren wie in der folgenden Gleichung abgeleitet ergeben:[95] , mit θ als dem Winkel zwischen den Vektoren der beiden Dipolmomente. Der Wert für g ist maximal, wenn µe und µm gleich groß und entweder parallel oder antiparallel ausgerichtet sind. Das niedrige µe des S0→S1-Übergangs begrenzt zwar sein Absorptionsvermögen, hat aber den Vorteil, dass es zu einer vergleichsweise starken chiroptischen Antwort führt, da der niedrige Wert von µe näher an µm liegt (welches für kleine organische Moleküle in der Regel deutlich kleiner ist). In Übereinstimmung mit den experimentellen g-Werten sinkt µe (in 10−20 esu cm) mit sinkender Ganghöhe von 166 für C6-[8]HDI auf 123 für C3-[8]HDI, während µm (in 10−20 erg G−1) von 1.90 auf 2.18 steigt. Entscheidend ist, dass die hohen g-Werte, die für die kürzer verbrückten Verbindungen beobachtet werden, nicht nur das Ergebnis der kleinen µe in ihren energetisch niedrigsten Übergängen sind, sondern gleichzeitig auf eine Erhöhung ihrer µm zurückgeführt werden können. Verglichen mit ihren verbrückten Gegenstücken weisen die offenkettigen Verbindungen N-Me-[8]HDI und N-nBu-[8]HDI ähnliche µe wie C3-[8]HDI auf, ihre µm sind jedoch erheblich niedriger. Aus den berechneten Werten für µe und µm sowie dem Winkel θ zwischen den Vektoren wurden die gabs-Werte ermittelt und mit den experimentellen Werten verglichen (Tabellen S8.1, S8.2).[96] Die berechneten Werte stimmen überwiegend mit den experimentellen Werten überein, auch wenn erstere insbesondere bei den längerkettigen Verbindungen etwas überschätzt werden. Werden µe, µm, und cos θ für den S0→S1-Übergang gegen die Ganghöhe aufgetragen, ergibt sich ein Überblick darüber, wie diese Werte durch die Ganghöhe beeinflusst werden (Abbildung 4d). Der beobachtete Anstieg der g-Werte mit abnehmender Ganghöhe resultiert somit aus einer gleichzeitigen Abnahme von µe und einem Anstieg von µm, während cos θ nahezu konstant bleibt.
Eine direkte Beziehung zwischen der Rotationsstärke R elektronischer Übergänge in helikalen Molekülen und dem Radius r sowie der Ganghöhe P wurde erstmals 1964 von Tinoco und Woody anhand des einfachen Modells des freien Elektrons auf einer Helix gezeigt.[97] In einer kürzlich durchgeführten theoretischen Studie wurde außerdem eine lineare Beziehung zwischen µm und der vom Rückgrat helicenartiger Moleküle umschlossenen Fläche nahegelegt.[98] Ein ähnlicher Mechanismus könnte für den Anstieg von µm und der Dissymmetriefaktoren in den kürzer verbrückten [8]HDIs verantwortlich sein.
Effekt der Ganghöhe auf die elektrochemischen Eigenschaften
In unserer früheren Veröffentlichung konnten wir zeigen, wie das Zusammenspiel der Wechselwirkungen zwischen den Imidgruppen durch die Bindungen und durch den Raum das Redoxverhalten der kleineren [n]HDIs (n = 5–7) beeinflusst.[34] Wir wiesen nach, dass die räumliche Annäherung der Imidgruppen – und damit der Redoxzentren – die Abnahme der Konjugation durch das Rückgrat der Moleküle mit zunehmender Länge der Helicene kompensieren kann. Die maximale Konjugation durch den Raum konnte bei [7]HDI beobachtet werden, bei dem die zwei terminalen aromatischen Ringe des [7]Helicen-Grundgerüsts überlappen. Bei den [8]HDIs erwarteten wir eine noch stärkere Konjugation durch den Raum hindurch, da die endständigen Naphthalimidgruppen hier direkt übereinander liegen (Abbildung 1a). Die elektrochemischen Eigenschaften der verbrückten [8]HDIs und der Referenzverbindungen N-Me-[8]HDI und N-nBu-[8]HDI, sowie die des fjord-methoxysubstituierten N-nBu-[8]HDI-f-OMe (Abbildung 5, Tabelle S5, Abbildungen S16–S18) wurden mittels Cyclovoltammetrie (CV) und Differentialpulsvoltammetrie (DPV) untersucht. Wie erwartet zeigen alle [8]HDIs zwei deutliche, reversible Reduktionswellen im CV- und zwei symmetrische Peaks im DPV-Plot, welche sequentiellen Ein-Elektron-Reduktionen der beiden Imidgruppen entsprechen. Im Gegensatz dazu konnte innerhalb des elektrochemischen Fensters von THF keine Oxidation nachgewiesen werden.
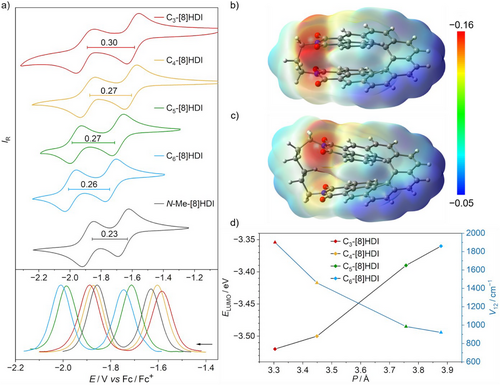
Es wurden mehrere Trends deutlich: (1) Der Wert von ΔEred für N-nBu-[8]HDI-f-OMe (0.25 V) ist in der Tat der größte in der homologen Reihe der fjord-methoxysubstituierten [n]HDIs (n = 5–8), was bestätigt, dass die Konjugation der Imidgruppen durch den Raum bei dieser Verbindung ein Maximum erreicht. Die anderen beiden offenkettigen [8]HDIs zeigen aufgrund der fehlenden Methoxygruppe etwas niedrigere Werte von ΔEred (∼0.23 V) – sowohl für N-Me-[8]HDI als auch N-nBu-[8]HDI. (2) Alle verbrückten Verbindungen weisen im Vergleich mit den offenkettigen Referenzverbindungen höhere Werte für ΔEred auf. (3) ΔEred steigt mit sinkender Ganghöhe von 0.26 V für C6-[8]HDI auf 0.30 V für C3-[8]HDI an, obgleich der Wert für C4-[8]HDI trotz der größeren Ganghöhe ähnlich zu dem für C5-[8]HDI ist. Dies deutet darauf hin, dass auch andere Effekte wie z. B. die elektronische Kommunikation über die Alkylbrücke, von Bedeutung sein könnten.
Das Redoxpotential der ersten Reduktion nimmt mit der Ganghöhe stetig ab, was einer leichteren Reduktion und folglich einem energetisch tiefer liegenden LUMO entspricht, während das HOMO bei allen untersuchten Verbindungen nahezu konstant bleibt (Abbildung 5, Tabelle S5). Dies lässt sich durch die bessere Stabilisierung negativer Ladungen durch zwei räumlich nahe beieinander liegende Imide erklären, was auch durch die berechneten molekularen elektrostatischen Potentialflächen (MEPs) der Radikalanionen (Abbildungen 5b und c, Abbildung S23) unterstützt wird. Aus diesen geht hervor, dass die negative Ladung bei den Molekülen mit einer kürzeren Brücke stärker zwischen den beiden Imidgruppen delokalisiert ist. Ebenso zeigt das berechnete LUMO des neutralen Moleküls für C3-[8]HDI eine signifikant verstärkte Orbitalüberlappung durch den Raum verglichen mit den höheren Homologen (Abbildung 1b, Abbildung S20).
Die starke elektronische Kopplung zwischen den beiden Redoxzentren wird weiter durch die (TD)-DFT-berechneten Intervalenz-Charge-Transfer-Parameter (IV–CT; Tabelle S10) ihrer Radikalanionen unterstützt. Die berechneten Werte für die elektronische Kopplung (V12) können als quantitatives Maß für die elektronische Kommunikation zwischen den beiden Redoxzentren dienen.[99, 100] Wie erwartet zeigen die berechneten Werte für V12 eine umgekehrt proportionale Beziehung zur Ganghöhe (Abbildung 5d). Der V12-Wert für C3-[8]HDI (1902 cm−1) ist fast doppelt so hoch wie der für C6-[8]HDI (922 cm−1), was verdeutlicht, dass die elektronische Kopplung zwischen den Redoxzentren stark von ihrer räumlichen Distanz abhängt, was die CV- und DPV-Daten weiter stützt (Tabelle S10).[101-103] Ähnlich wie bei den kleineren Homologen ([n]HDI, n = 5–7) ist die V12-Energie der Radikalanionen aller [8]HDIs kleiner als die Hälfte ihrer Reorganisationsenergie (V12 < λ / 2), womit sie als Robin-Day-Klasse II gemischtvalente Verbindungen klassifiziert werden können.[104]
Abschluss
Zusammenfassend haben wir durch den Einbau von Alkylbrücken in [8]Helicendiimid molekulare Federn auf Basis von [8]HDIs in wohldefinierten gestauchten und gedehnten Konformationen fixiert. Durch Röntgenstrukturanalyse zeigte sich, dass eine Erhöhung oder Verringerung der Alkylkettenlänge zu einer systematischen Vergrößerung bzw. Verkleinerung der Ganghöhe führt, was wiederum sowohl die Redox- als auch die chiroptischen Eigenschaften erheblich beeinflusst. Insbesondere stabilisiert eine verringerte Ganghöhe das LUMO durch verstärkte Wechselwirkung zwischen den Imidgruppen durch den Raum, was zu niedrigeren Reduktionspotentialen und einem größeren Unterschied zwischen den Reduktionspotentialen der beiden Imide führt. Damit einhergehend werden die optischen Eigenschaften deutlich beeinflusst – eine geringere Ganghöhe führt zu einer bathochromen Verschiebung der energetisch niedrigsten Absorptions- und Emissionsbanden und sowohl die Absorptions- (gabs) als auch die Lumineszenz-Dissymmetriefaktoren (glum) steigen linear an, wobeifür C3-[8]HDI Werte bis zu ∼ 6 × 10−2 erreicht werden. Unsere Ergebnisse unterstreichen, dass präzise Konformationskontrolle zur effektiven Steuerung der Eigenschaften kleiner helikal chiraler Moleküle eingesetzt werden kann. Aus unserer Arbeit geht hervor, dass die Verbrückung funktioneller Gruppen mit Alkylketten eine wirksame Strategie ist, um eine solche Kontrolle zu erreichen. Laufende Studien in unserer Arbeitsgruppe zielen darauf ab, die Struktur-Eigenschaftsbeziehungen von [n]HDIs weiter aufzuklären, um ihre Leistungsfähigkeit als chirale organische Funktionsmaterialien zu optimieren.
Hintergrundinformationen
Die Autoren haben zusätzliche Referenzen in der Supporting Information zitiert.[105-118] Die Supporting Information enthält das Folgende: Experimentelle und Berechnungsdetails, Materialien, Synthese und Charakterisierung, zusätzliche spektroskopische Daten, HPLC-Plots, die Tabellen S1 bis S17 und die Abbildungen S1−S103. Deposition Numbers 2434331 (for rac-C3-[8]HDI), 2434333 (for rac-C4-[8]HDI), 2434334 (for rac-C5-[8]HDI), 2434335 (for rac-C6-[8]HDI), 2434337 (for rac-N-Me-[8]HDI Polymorph 1), 2434338 (for rac-N-Me-[8]HDI Polymorph 2), 2434339 (for rac-N-nBu-[8]HDI), 2434330 (for (M)-C3-[8]HDI), 2434332 (for (M)-C3-[8]HDI), 2434336 (for (P)-N-Me-[8]HDI) contain the supplementary crystallographic data for this paper. These data are provided free of charge by the joint Cambridge Crystallographic Data Centre and Fachinformationszentrum Karlsruhe. Access structures service.
Danksagung
Wir bedanken uns beim European Research Council (ERC) (ERC-Starting Grant, Project no. 101041464) für finanzielle Unterstützung. Das CD/CPL-Hybridspektrometer wurde von der DFG finanziert (Project No. 444286426). P. R. dankt Prof. C. Lambert (JMU) für die großzügige Unterstützung seiner Forschungsgruppe.
Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Kurzzusammenfassung
Research data are not shared.




