Aluminiumalkylinduzierte Isomerisierung von Gruppe IV meso Metallocen Komplexen
Abstract
Bei der Synthese von Gruppe IV Metallocen-Präkatalysatoren für die Polymerisation von Propylen werden im Allgemeinen zwei verschiedene Isomere gebildet: Das racemische Isomer, das isotaktisches Polypropylen (iPP) produziert und das meso-Isomer, das ataktisches Polypropylen (aPP) produziert. Aufgrund seiner vergleichbar schlechten physikalischen Eigenschaften ist die Anwendung von aPP sehr begrenzt. Um Mischungen beider Polymere zu vermeiden, was die mechanischen und thermischen Eigenschaften von iPP zu verschlechtern würde, müssen die meso Metallocenkomplexe mühsam von den racemischen Komplexen getrennt werden, was die Metallocen-basierte Polymerisation von Propylen industriell weit weniger attraktiv macht als das Ziegler/Natta-Verfahren. Um dieses Problem zu umgehen, haben wir ein Isomerisierungsprotokoll zur Umwandlung von meso Metallocenkomplexen in ihre racemischen Analoga entwickelt. Dieses Protokoll steigerte die Ausbeute an iPP um 400 %, wobei die hervorragenden physikalischen Eigenschaften des Polymers beibehalten wurden; es war sowohl auf Hafnocen-, als auch auf Zirkonocenkomplexe, sowie auf verschiedene Methoden zur Aktivierung des Präkatalysators anwendbar. Durch gezielte Variation der Liganden wurden Methoxygruppen an den Indenylsubstituenten als die für eine Isomerisierung verantwortlichen Strukturmotive gefunden - dieser experimentelle Nachweis wurde durch Dichtefunktionaltheorieberechnungen bestätigt. Flüssig-Injektion-Feld-Desorption-Ionisierung-Massenspektrometrie, sowie 1H- und 29Si-Kernresonanzstudien ermöglichten den Vorschlag eines Isomerisierungsmechanismus.
Einleitung
Die Entdeckung der koordinativen Polymerisation von Ethylen und Propylen durch Ziegler und Natta in den 1950er Jahren stellte den bis heute wohl wichtigsten Durchbruch in der Polymerforschung dar.1 30 Jahre später gelang es Brintzinger und Kaminsky, definierte homogene ansa-Zirkonocen Komplexe für die isoselektive Polymerisation von Propylen herzustellen.2 Unter Verwendung von Methylaluminoxan (MAO) als Co-Katalysator konnten sie Polypropylen mit weitaus höheren Molekulargewichten und schmaleren Molekulargewichts-verteilungen herstellen als die Ziegler/Natta-Systeme auf der Basis von TiCl4/ID/MgCl2 (ID=interner Elektronendonor). Heutzutage stützt sich die Forschung zur homogenen Polymerisation von Propylen immer noch auf diese Pionierarbeit. Die Maximierung der Katalysatorleistung, sowie der Stereo-regularität und des Molekulargewichts des hergestellten Polymers wurde jedoch zum Hauptaugenmerk und neue Techniken wie High-Throughput-Screening werden etabliert, um diese Ziele zu erreichen.3 Für die Produktion von hochisotaktischem Polypropylen spielen Metallocene auf Indenylbasis eine entscheidende Rolle. Unter Verwendung des ultra-rigiden ansa-Hafnocen Komplexes rac-IHf konnte unsere Gruppe iPP mit der bisher höchsten Schmelzübergangstemperatur ex Reaktor herstellen.4 Ein Problem, das nicht nur unseren Hafnocen Komplex, sondern alle Metallocen-Präkatalysatoren auf Indenylbasis betrifft, ist die mühsame und manchmal unmögliche Trennung der racemischen (rac) und meso Isomere dieser Komplexe.5 Während die racemischen Metallocen-Spezies isotaktisches Polypropylen (iPP) produzieren, produzieren ihre meso-Analoga laut Ewen's Symmetrie-Regeln unerwünschtes ataktisches Polypropylen (aPP).6 Da bei Metallocen Synthesen in der Regel beide Isomere gebildet werden, müssen die racemischen Isomere in sehr reiner Form erhalten werden, bevor ein Präkatalysator für die isoselektive Polymerisation von Propylen als eingesetzt werden kann. Solch eine Aufreinigung besteht in der Regel aus mehreren fraktionierten Kristallisationen der Komplexe und vermindert somit die Ausbeute des racemischen Isomers; außerdem werden erhebliche Mengen der wertvollen Liganden in Form von verworfenen meso-Isomeren verschwendet. In Anbetracht der teuren und zeitaufwändigen Herstellung von Metallocen Präkatalysatoren trägt diese Tatsache dazu bei, dass die homogene Polymerisation von Propylen industriell eher unrentabel ist. Es gibt zwar einige Protokolle zur Umwandlung von meso-Metallocen Komplexen in ihre racemischen Analoga, diese sind jedoch nur begrenzt anwendbar, da häufig ein Gleichgewichtszustand zwischen beiden Isomeren erreicht wird und die Synthese von Präkatalysatoren um einen zusätzlichen, arbeitsintensiven Reinigungsschritt ergänzt wird.7 Kürzlich berichteten wir über die Isomerisierung des Hafnocen-Komplexes meso-IHf durch reaktion mit 1.00 Äquivalenten (Äq.) Triisobutylaluminium (TIBA).8 Die anschließende in situ Aktivierung mit 200 Äq. TIBA und 5.00 Äq. [Ph3C][B(C6F5)4] (TrBCF) ergab perfekt isotaktisches Polypropylen mit makromolekularen Eigenschaften analog zu iPP, das mithilfe der reinen racemischen Isomere hergestellt wurde.
In diesem Artikel haben wir die Isomerisierungsbedingungen hinsichtlich der TIBA-Konzentration, der Reaktionstemperatur und -zeit optimiert, um eine gründlichere Isomerisierung zu erreichen. Wir haben das für die Isomerisierung verantwortliche strukturelle Motiv der Komplexe untersucht und konnten einen Reaktionsmechanismus postukieren, der auf Dichtefunktional-theorie (DFT) sowie Ergebnissen aus Flüssig-Injektion-Feld-Desorption-Ionisierung-Massenspektrometrie (LIFDI-MS) und verschiedenen Kernspinresonanz (NMR) Experimenten basiert. Derzeit werden sowohl in der Forschung als auch in der Industrie Zirkonocenkomplexe für die Herstellung von Polypropylen bevorzugt, während ihre schwereren Analoga weit weniger Beachtung finden.9 Aus diesem Grund haben wir den Anwendungsbereich des Isomerisierungsprotokolls auf verschiedene Zirkonocen/MAO-Systeme, aber auch auf strukturell unterschiedliche Hafnocenkomplexe ausgedehnt, die durch 1H- und 29Si NMR-Studien nachgewiesen wurden.
Ergebnisse und Diskussion
Komplex Synthesen
Das Isomerisierungsverhalten des Komplexes meso-IHf durch Reaktion mit TIBA wurde in unserer früheren Arbeit untersucht.8 Um die strukturellen Motive des Liganden zu identifizieren, die für die Isomerisierung verantwortlich sind, wurden die Hafnocenkomplexe meso IHf–VHf, sowie ihre entsprechenden Zirkonocen-Analoga meso IZr–VZr synthetisiert und ihre Reaktionen mit TIBA untersucht (Schema 1).
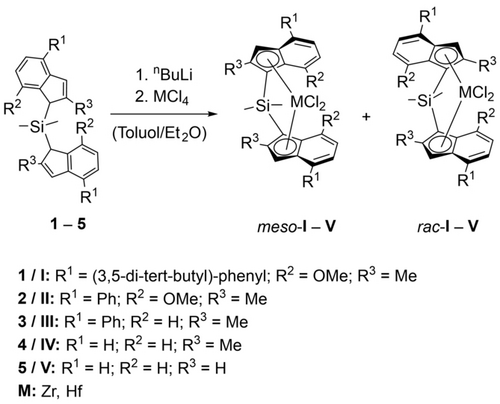
Synthesen der Metallocen Komplexe I–V.
Die Synthesen der Komplexe I–V ergaben Isomerengemische, die von rac/meso 2/1 bis zu reinem meso reichten, abhängig von jedem einzelnen Präkatalysator. Das Vorhandensein von racemischen Isomeren hatte keinen Einfluss auf das Isomerisierungsverhalten der entsprechenden meso-Spezies. Daher haben wir nicht bei allen Komplexen die reinen meso-Isomere isoliert. Die Komplexe IIZr, IIIHf und IVHf waren bisher nicht literatur-bekannt. Ihre Synthese wurde analog zu den literaturbekannten Analoga durchgeführt und ergab rac/meso Gemische in verschiedenen Verhältnissen.3b, 10 Die racemischen Isomere wurden durch fraktionierte Kristallisation abgetrennt und mittels 1H-, 13C- und 29Si NMR-Spektroskopie, sowie LIFDI-MS umfassend charakterisiert. IIZr wurde zusätzlich mit Hilfe von Einkristall-Röntgenbeugung (SC-XRD) charakterisiert.11 Der Komplex VHf wurde bereits in der Literatur beschrieben,12 wurde aber unseres Wissens nach nie gründlich charakterisiert. Daher haben wir seine Charakterisierung mithilfe von NMR, MS und SC-XRD durchgeführt.
Optimierung der Isomerisierungsbedingungen
In unseren vorigen Arbeiten wurden Isomerisierungsexperimente durchgeführt, bei denen der Metallocenkomplex und 1.00 Äq. TIBA in Toluol zusammengegeben wurden und die Mischungen 16 Stunden lang auf 100 °C erhitzt wurden, um eine vollständige Umwandlung von meso zu rac zu erreichen. Bei diesem Verfahren traten jedoch geringe Mengen an Nebenprodukten auf, die in den 1H NMR-Spektren der isomerisierten Komplexe sichtbar waren.8 Obwohl diese Nebenprodukte die Polymerisationsleistung der aktivierten Katalysatoren nicht beeinträchtigten, strebten wir dennoch eine vollständige Isomerisierung an, um die Ausbeute der racemischen Isomere und damit des später hergestellten isotaktischen Polypropylens zu maximieren. Wir optimierten daher die Isomerisierungs-bedingungen und stellten fest, dass Nebenprodukte vermieden werden konnten, indem wir die TIBA-Menge auf 0.50 Äquivalente reduzierten und die Reaktionstemperatur auf 120 °C erhöhten; die Umsätze wurden mit 1H NMR -Spektroskopie überwacht. Sechzehn Stunden Reaktionszeit waren für eine vollständige Umwandlung des Komplexes meso-IHf erforderlich, während für die Komplexe meso-IZr, meso-IIHf und meso-IIZr nur eine bis vier Stunden benötigt wurden. Das Fehlen anderer Signale neben den racemischen Produkten in den 29Si NMR -Spektren beweist, dass tatsächlich eine Isomerisierung der Komplexe zu den entsprechenden racemischen Spezies stattgefunden hat - und nicht nur ein Abbau der meso-Isomere (Schema 2). Der direkte Vergleich der jeweiligen Metallocenkomplexe zeigte, dass die Isomerisierung der Zirkonocenkomplexe tendenziell schneller erfolgte (3 h für meso-IZr und 1 h für meso-IIZr) als die Isomerisierung der entsprechenden Hafnocen-Analoga (16 h für meso-IZr und 4 h für meso-IIZr). Trimethylaluminium (TMA) war ebenfalls geeignet, diese Mesokomplexe zu isomerisieren; aufgrund der bekannten Tatsache, dass TMA die Aktivität der Hafnocenkomplexe bei der Propylen-Polymerisation stark beeinträchtigt, wurde es jedoch nur für mechanistische Studien und nicht für Polymerisationsexperimente verwendet.13
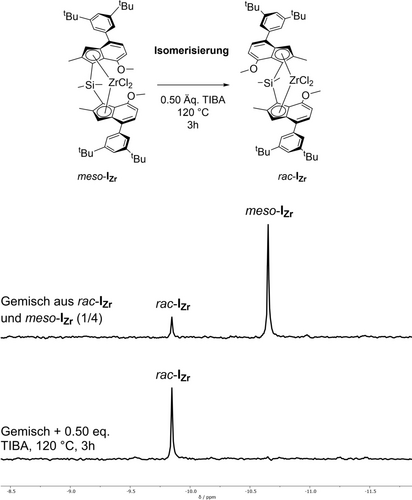
Auszüge aus den 29Si NMR -Spektren eines Gemisches aus rac-IZr und meso-IZr vor und nach der Isomerisierung gemäß der dargestellten Reaktion unter Verwendung von 0.50 Äq. TIBA bei 120 °C für 3 h. Die vollständigen Spektren für alle Isomerisierungsexperimente sind in der Hintergrundinformationen enthalten.
In Abwesenheit von TIBA oder TMA wurde für den Komplex meso-IHf keine Isomerisierung beobachtet, während für meso-IIHf, meso-IZr und meso-IIZr teilweise eine Isomerisierung beobachtet werden konnte. Bei all diesen Kontrollexperimenten bildeten sich jedoch vermehrt Nebenprodukte. Bei den Komplexen meso-III, meso-IV und meso-V (M: Zr, Hf) wurde unter verschiedenen Bedingungen keine Isomerisierung beobachtet, was beweist, dass sowohl die Methoxygruppen der Metallocenkomplexe als auch das Vorhandensein eines Aluminiumalkyls ausschlaggebend dafür sind, dass eine Isomerisierung stattfinden kann. Auf die Rolle beider Gruppen wird später näher eingegangen.
Polymerisationsexperimente mit Isomerisierten Metallocen Komplexen
Zum Vergleich der Polymerisationsleistungen von isomerisierten meso-I und meso-II (M: Zr, Hf) sowie ihrer racemischen Analoga wurden Propylenpolymerisationen durchgeführt. Die resultierenden Polymere wurden anhand ihres Molekulargewichts, ihrer Stereoregularität und ihrer Schmelzübergangstemperatur charakterisiert (Tabelle 1).
Eintrag |
Präkatalysator |
n[b] |
Aktivierung[c] |
TPolym[d] |
tPolym[e] |
[mmmm] [f] |
Mw[g] |
Ð[h] |
Tm[d] |
P[i] |
|---|---|---|---|---|---|---|---|---|---|---|
17 |
rac-IHf |
1.65 |
TIBA/TrBCF |
30 |
30 |
>99 |
1600 |
1.6 |
165 |
6000 |
27 |
rac/meso-IHf (1/4) [j] |
1.65 |
TIBA/TrBCF |
30 |
30 |
>99 |
1300 |
1.6 |
165 |
5000 |
3 |
rac-IIHf |
1.30 |
TIBA/TrBCF |
30 |
15 |
99 |
500 |
1.8 |
160 |
1200 |
4 |
rac/meso-IIHf (1/4) [j] |
1.30 |
TIBA/TrBCF |
30 |
15 |
>99 |
700 |
1.6 |
161 |
1000 |
5 |
rac-IZr |
1.64 |
MAO |
30[k] |
15 |
>99 |
700 |
2.9 |
159 |
32000 |
6 |
rac/meso-IZr (1/4) [j] |
1.64 |
MAO |
30 |
15 |
>99 |
800 |
2.5 |
159 |
30000 |
7 |
rac-IIZr |
1.45 |
MAO |
60 |
15 |
98 |
600 |
1.6 |
156 |
10000 |
8 |
rac/meso-IIZr (1/4) [j] |
1.45 |
MAO |
60[k] |
15 |
98 |
700 |
2.1 |
155 |
15000 |
- [a] VToluol=120 mL; p=pAr+pPropylen=4 bar, pAr=1.5 bar. [b] In μmol. [c] TIBA/TrBCF: Initiator [Ph3C][B(C6F5)4]=5.00 Äq., Aktivator (TIBA)=200 Äq., Scavenger (TIBA)=0.55 mmol; Methylaluminoxan (MAO): Scavenger=Aktivator (MAO)=2000 Äq. [d] In °C. [e] In min. [f] In %, bestimmt via 13C NMR Spectroskopie mit Annahme des enantiomorphic site Modells. [g] In kg mol−1, bestimmt absolut via SEC-GPC in 1,2,4-Trichlorbenzol bei 160 °C mit dn/dc=0.097 mL g−1. [h] Ð=Mw/Mn. [i] in kgPP [molcat h]−1. [j] Prä-isomerisiert mit 1.00 Äq. (Eintrag 2)/0.50 Äq. (Eintrag 4, 6, 8) TIBA bei 120 °C. [k] ±10 °C.
Die Polymerisationen mit Hafnocenkomplexen wurden analog zu unseren früheren Arbeiten mit der in situ Aktivierungsmethode mit TIBA/TrBCF durchgeführt. Wie aus Tabelle 1 hervorgeht, ergab die Isomerisierung von meso-IHf und meso-IIHf und die anschließende in situ Aktivierung iPP mit den gleichen Eigenschaften wie iPP, das aus den entsprechenden reinen racemischen Isomeren hergestellt wurde, was eine vollständige Isomerisierung beweist. Im Gegensatz zu Hafnocenkomplexen, die bei Verwendung von MAO in der Regel nur unzureichend aktiviert werden,13 lassen sich Zirkonocen-Präkatalysatoren verlässlich mit MAO aktivieren; diese Aktivierung wird generell häufiger eingesetzt.9a, 14 Daher wollten wir zusätzlich zur in situ Aktivierung von Hafnocenkomplexen unser Isomerisierungs-/Polymerisierungsprotokoll auf Zirkonocenkomplexe ausweiten, die anschließend mit MAO aktiviert wurden. iPP aus den isomerisierten Zirkonocenkomplexen meso-IZr und meso-IIZr, die mit MAO aktiviert wurden, wiesen die gleichen makromolekularen Eigenschaften auf wie iPP, das durch die direkte MAO-Aktivierung der entsprechenden racemischen Isomere hergestellt wurde. Offensichtlich funktionierte die MAO-Aktivierung bei zuvor isomerisierten Zirkonocenkomplexen genauso gut und wurde zudem nicht durch restkiches TIBA, das für die Isomerisierung verwendet wurde, behindert. Die Löslichkeit vieler handelsüblicher MAO-Lösungen wird ohnehin durch die Zugabe von TIBA verbessert.15 In unserer früheren Arbeit haben wir gezeigt,8 dass die direkte Zugabe von MAO zu meso-Metallocen-Komplexen jedoch zur Bildung von ataktischem Polypropylen führte, was wir auf die Fähigkeit von MAO zurückführten, selbst eine freie Koordinationsstelle am zentralen Metallatom zu erzeugen. Dies unterstreicht die Notwendigkeit einer vollständigen Isomerisierung entweder mit TIBA oder TMA, bevor MAO eingesetzt wird.
Eine der größten Komplikationen bei Polymerisationen, die auf Metallocen-Präkatalysatoren beruhen, besteht darin, dass ihre Synthesen meso und rac Isomere in einem Verhältnis von bis zu 4/1 produzieren.8 Das hier vorgestellte Isomerisierungs-/Polymerisationsprotokoll umgeht das Problem der Verschwendung wertvoller Metallocenkomplexe sowohl für Hafnocen- als auch für Zirkonocenkomplexe, selbst bei unterschiedlichen Aktivierungsmethoden, während die gewünschten Polymereigenschaften gleichzeitig erhalten werden.
Strukturmotive Verantwortlich für die Isomerisierung
Während die Komplexe meso-I und meso-II (M: Zr, Hf) bei 120 °C nach Zugabe von 0.50 Äq. TIBA isomerisiert wurden, zeigten die Komplexe meso-III, meso-IV und meso-V (M: Zr, Hf) keine Isomerisierung bei Temperaturen von 60 °C bis 120 °C und TIBA-Konzentrationen von 0.20 Äq. bis 10.0 Äq. Darüber hinaus konnte keine Isomerisierung dieser Komplexe unter Verwendung des sterisch weniger anspruchsvollen TMA beobachtet werden; in unserer früheren Arbeit haben wir gezeigt, dass dieses Reagenz auch geeignet war, eine Isomerisierung von meso-IHf zu induzieren.8 Das Isomerisierungsphänomen scheint also unabhängig vom zentralen Metallatom zu sein - eine Beobachtung, die auf die grundlegende chemische Ähnlichkeit von Hafnium und Zirkonium hinsichtlich ihrer Elektronegativität sowie ihrer Atom- und Ionenradien zurückgeführt werden kann.16 Die dargestellten Ergebnisse deuten jedoch darauf hin, dass die Methoxysubstituenten an Position 7 der Indenylgerüste der Liganden die entscheidenden Faktoren sind, damit eine aluminiumalkylinduzierte Isomerisierung stattfinden kann. Unabhängig von den sterischen Anforderungen der Aryleinheiten wurden nur meso-Metallocenkomplexe, die diese strukturellen Motive tragen, zu ihren racemischen Analoga isomerisiert. Bei der Beobachtung der Isomerisierung mittels 1H NMR-Spektroskopie konnten wir – abgesehen von den unten beschriebenen Unterschieden zwischen den beiden Isomeren und den Zwischenprodukten – keine Veränderungen der chemischen Verschiebungen dieser Methoxygruppen feststellen. Wir interpretieren diese Ergebnisse dahingehend, dass es sich um ein hypothetisches hochenergetisches Zwischenprodukt handelt, dessen Lebensdauer kürzer ist als die NMR-Zeitskala und das daher mit dieser Analysemethode nicht nachweisbar ist.
Mithilfe von DFT mit dem B3LYP-Standardfunktional (siehe Hintergrundinformationen) wurden die Energien berechnet, die die Liganden 2 und 3 benötigen, um die Geometrie, die sie in den jeweiligen racemischen und meso Hafnocen Komplexen einnehmen, anzupassen (Abbildung 1).
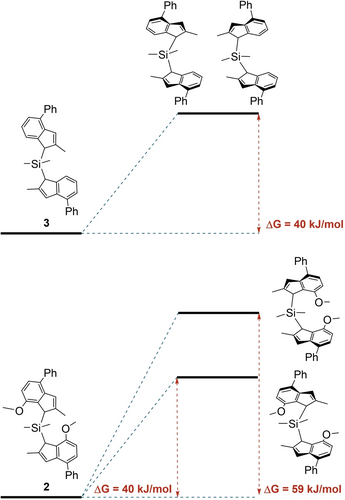
Energiediagramme der Umwandlung der Liganden 2 und 3 in die Konformere, die zur Bildung der jeweiligen racemischen und meso Metallocen Komplexe erforderlich sind.
40 kJ/mol sind erforderlich, um jedes Konformer des Liganden 3 zu bilden, der keine Methoxygruppen trägt, sodass keine Konformation, weder rac-IIIHf, noch meso-IIIHf, energetisch bevorzugt ist. Der Ligand 2 hingegen benötigt 40 kJ/mol, um Hf zu komplexieren und rac-IIHf zu bilden, aber 59 kJ/mol, um die Geometrie von meso-IIHf einzunehmen. Der Energieüberschuss ist erforderlich, um die aromatischen Gruppen am Siliciumatom um ~10° von den 105° im freien Liganden zur Konformation mit einem zentralen Metallatom zu biegen. Folglich wird das meso Isomer um 19 kJ/mol im Vergleich zu rac-IIHf destabilisiert, was hauptsächlich auf die intramolekulare Spannung im komplexierten Liganden 2 zurückzuführen ist (Tabelle S1). Daher sind die Methoxygruppen an Position 7 des Indenylgerüsts letztlich für die Isomerisierung verantwortlich, wobei die treibende Kraft die relativen thermodynamischen Stabilitäten der meso und rac Konformationen von Metallocenkomplexen mit diesen Substituenten sind. Der Grund dafür, dass meso-I und meso-II (M: Zr, Hf) neben ihren racemischen Gegenstücken während der Metallocensynthesen überhaupt gebildet werden, scheint also kinetischen Ursprungs zu sein. Es ist denkbar, dass die durch Deprotonierung der Bis(indenyl)-Vorstufen erhaltenen di-lithiierten Spezies eine Art Lithium-Sauerstoff-Chelatbildung aufweisen. Es scheint also eine Vororientierung beider Ligandenstellen vor dem Transmetallierungsschritt mit dem Gruppe-IV-Metallhalogenid stattzufinden, wodurch die thermodynamisch weniger begünstigten meso-Isomere bis zu 80 % entstehen.
Mechanismus der Isomerisierung
Während die energetischen Unterschiede zwischen den Ligandenkonformationen, die für die Bildung von meso-IIHf und rac-IIHf erforderlich sind, die Triebkraft der Isomerisierung erklären, reichen sie jedoch nicht aus, um den detaillierten Reaktionsmechanismus aufzuzeigen. Da in Abwesenheit von TIBA oder TMA für keinen der Komplexe eine vollständige Isomerisierung bei 120 °C beobachtet wurde, kann eine rein thermische Isomerisierung ausgeschlossen werden, und es wird klar, dass das jeweilige Aluminiumalkyl in irgendeiner Weise als Katalysator für die Isomerisierung dient.
Um weitere Einblicke in den Isomerisierungsmechanismus zu gewinnen, wurden eine kinetische 1H NMR-Studie und LIFDI-MS-Experimente zur Umwandlung von meso-IHf mit TMA durchgeführt. Da die letztgenannte Methode noch nicht sehr weit verbreitet ist, wird in der Hintergrundinformationen ein kurzer Überblick über ihre Funktionsweise und ihre spezifischen Vorteile bei der Aufklärung unseres Isomerisierungsmechanismus gegeben. Wie mittels 1H NMR sichtbar wurde, verlief die Isomerisierung über zwei verschiedene Zwischenstufen: Eine symmetrische Spezies, die aus meso-IHf über 90 Minuten bei 100 °C gebildet wurde, und eine asymmetrische Spezies, die aus diesem symmetrischen Zwischenprodukt innerhalb von vier Stunden bei 100 °C entstand. Die letztere Spezies wurde anschließend teilweise in rac-IHf umgewandelt. Diese asymmetrische Spezies war unter Argon-Atmosphäre stabil (>15 Tage), und die Entfernung der überstehenden Lösung sowie des restlichen TMA im Vakuum führte nicht zur Zersetzung. Im 1H-NMR Spektrum wies die symmetrische Spezies einen charakteristischen Peak bei δ=−1,28 ppm mit einem relativen Integral von 3 auf, was auf eine Hf-Methylgruppe hindeutet. Wir schlossen daher, dass es sich bei dieser Spezies um das mono-methylierte meso-IHfMe handelte (Abbildung 2).
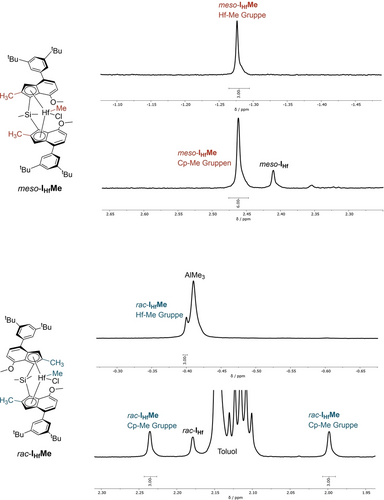
Auszüge aus den 1H NMR-Spektren von meso-IHfMe und rac-IHfMe. Die entsprechenden Protonen sind in den abgebildeten chemischen Strukturen hervorgehoben. Die vollständigen Spektren befinden sich in der Hintergrundinformationen.
Das 29Si NMR-Spektrum der endgültigen Reaktionsprodukte (Abbildung S45) zeigte neben dem Signal von rac-IHf nur ein weiteres Signal, was beweist, dass es sich bei der erwähnten asymmetrischen Spezies tatsächlich um eine einzige Spezies und nicht um zwei symmetrische Spezies mit gleichen relativen Integralen handelt. Darüber hinaus wies das 1H NMR-Spektrum dieser Spezies ein Signal bei δ=−0,40 ppm mit einem relativen Integral von 3 auf, was auf eine weitere Hf-Methyleinheit hindeutet. Wir schlossen, dass es sich bei dieser Spezies um rac-IHfMe handelt (Abbildung 2); LIFDI-MS bestätigte diese Vermutung (Abbildung S50). Ausgewählte Signale in den jeweiligen 1H NMR -Spektren von meso-IHfMe und rac-IHfMe sind in Abbildung 2 dargestellt. Die erwähnten Hf-Methylgruppen sowie die Cyclopentadienyl-(Cp)-Methylgruppen sind jeweils hervorgehoben.
Die Methylgruppen an den Cp-Einheiten der Metallkomplexe erwiesen sich als gut geeignet, die relativen Mengen der einzelnen Spezies während des Isomerisierungsprozesses zu unterscheiden. Auszüge der entsprechenden 1H NMR -Spektren des kinetischen NMR-Experiments in diesem Spektralbereich sind in Abbildung 3 zusammengefasst.
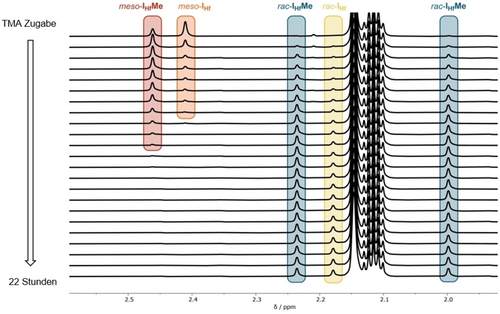
Auszüge aus den 1H NMR Spektren der Reaktion von meso-IHf mit 2.00 Äq. TMA bei 100 °C. Die gesamten Spektren befinden sich in der Hintergrundinformationen.
Die relativen Häufigkeiten von meso-IHfMe, meso-IHf, rac-IHf und rac-IHfMe wurden durch Integration der in Abbildung 3 hervorgehobenen Signale ermittelt. Diagramme dieser Mengen im Verlauf von 90 Minuten bzw. 22 Stunden sind in Abbildung 4 dargestellt.
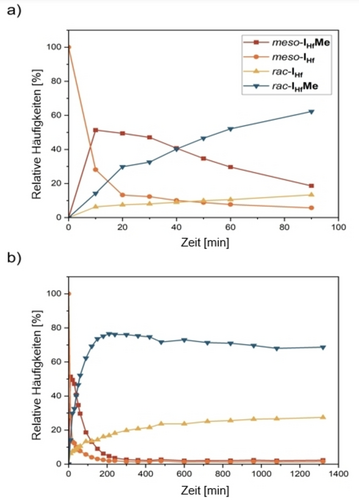
Relative Häufigkeiten von meso-IHfMe, meso-IHf, rac-IHf und rac-IHfMe während der Reaktion von meso-IHf mit 2.00 Äq. TMA bei 100 °C. Zur besseren Übersicht ist Diagramm a) eine vergrößerte Darstellung der ersten 90 min von Diagramm b). Die Häufigkeiten wurden durch Integration der Cp-Methylgruppen bestimmt.
Wir konnten rac-IHfMe auch durch die direkte Reaktion von rac-IHf mit TMA erhalten; in diesem Fall wurden jedoch weder meso-IHfMe, noch meso-IHf als zusätzliche Reaktionsprodukte nachgewiesen. Analoge methylierte, asymmetrische Produkte waren auch in den jeweiligen 1H NMR-Spektren nachweisbar, wenn rac-IZr, rac-IIHf und rac-IIZr in Gegenwart von TMA auf 100 °C erhitzt wurden (siehe Hintergrundinformationen). LIFDI-MS bestätigte, dass die Molekularmassen der Reaktionsprodukte mit den berechneten Werten für die entsprechenden methylierten Spezies übereinstimmten. Zusätzlich zu dem oben diskutierten kinetischen 1H NMR-Experiment verwendeten wir LIFDI-MS, um die Reaktion von meso-IHf mit TMA in situ zu verfolgen. Interessanterweise beobachteten wir eine Spezies mit einer Masse, die der kombinierten Masse von meso-IHf und TMA entsprach (Abbildung 5). Da Feld-Desorption eine sehr sanfte Ionisierungsmethode ist, handelt es sich bei dieser Spezies höchstwahrscheinlich nicht um ein Artefakt der massenspektro-metrischen Untersuchung, sondern um ein tatsächliches Reaktionsprodukt (eine detaillierte Erklärung befindet sich in der Hintergrundinformationen).
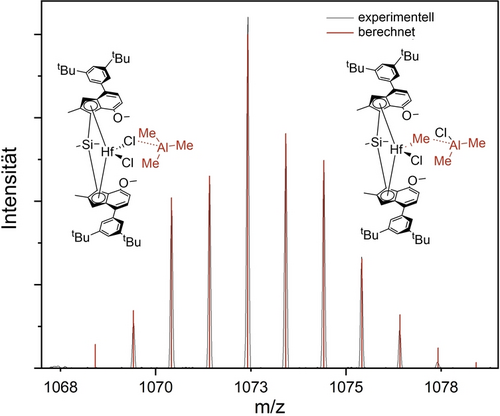
Berechnete Isotopenverteilung und detektierte Massen von meso-IHf+TMA.
Wir hielten drei verschiedene Strukturen für die Komplex/TMA-Wechselwirkung für denkbar: Die erste und von uns als am wahrscheinlichsten erachtete ist in Abbildung 5 dargestellt und beinhaltet die Wechselwirkung von TMA mit den Chloridsubstituenten am zentralen Metallatom – entweder vor oder nach einer Methylaustauschreaktion, die in Kürze diskutiert wird. Die beiden anderen möglichen Koordinationsstellen des elektrophilen TMA sind die elektronenreichen Cp-Ringe, sowie die Methoxygruppen von meso-IHf. Laut DFT-Rechnungen anhand der Komplexe IIHf und IIIHf (Tabelle S2) sind alle drei Wechselwirkungen möglich, wobei keine energetisch signifikant gegenüber den anderen bevorzugt ist. Die Wechselwirkung mit den Chloridsubstituenten ist jedoch energetisch zumindest leicht um bis zu 15 kJ/mol bzw. 14 kJ/mol gegenüber einer Wechselwirkung mit den Cp-Ringen und den Methoxygruppen begünstigt. Darüber hinaus ändern die beiden anderen Wechselwirkungen die Geometrie um das zentrale Metallatom nicht signifikant, was eine Voraussetzung dafür wäre, dass die jeweilige Spezies am Isomerisierungsmechanismus beteiligt ist, während die Koordination von TMA an einen Chloridsubstituenten die jeweilige Hf−Cl-Bindung verlängert. Daher wird sich die folgende Diskussion nur auf die TMA/Chlorid-Wechselwirkung konzentrieren.
Die Chlorid/Methyl-Austauschreaktion von Metallocendichloriden mit TMA über eine L2ClHf(μ-Cl)AlMe3-Spezies (L=Ligand) ist in der Literatur gut beschrieben.17 Wir haben DFT-Rechnungen dieser Reaktion für meso/rac-IIHf und den analogen Komplex ohne Methoxygruppen meso/rac-IIIHf durchgeführt (für IHf wurden keine Berechnungen durchgeführt, da IIHf erheblich weniger Atome als IHf enthält und beide experimentell das gleiche Verhalten zeigten). Die Energetik dieser Reaktion ist in Tabelle S3 zusammengefasst und zeigt, dass die Ausgangsspezies L2ClHf(μ-Cl)AlMe3 in jedem Fall energetisch leicht gegenüber der entsprechenden methylierten Spezies L2ClHf(μ-Me)AlMe2Cl bevorzugt ist. Die Methylierung von meso-IIHf ist jedoch um 13 kJ/mol gegenüber der Methylierung seines racemischen Analogons bevorzugt. Im Vergleich dazu verhält sich Komplex IIIHf umgekehrt und die Methylierung des racemischen Isomers ist um 11 kJ/mol gegenüber der Methylierung seines meso Gegenstücks bevorzug. Da nur Komplex IIHf experimentell isomerisiert werden konnte, kamen durch in Betracht Ziehen dieser energetischen Diskrepanz zu dem Schluss, dass die Metall-Chlorid-TMA-Wechselwirkung ein entscheidender Schritt des Isomerisierungsmechanismus ist. Auf der Grundlage der vorgelegten Daten postulieren wir einen Mechanismus für die TMA-induzierte Isomerisierung von Methoxy-substituierten meso Metallocenkomplexen, wie in Schema 3 dargestellt – am Beispiel von meso-IHf, da die kinetischen NMR-Daten von diesem Komplex gesammelt wurden.
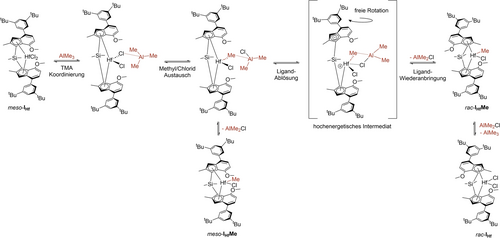
Vorgeschlagener TMA-induzierter Isomerisierungsmechanismus von Methoxy-substituierten Gruppe IV Metallocenkomplexen am Beispiel von meso-IHf.
Unsere vorgeschlagene Reaktionssequenz beginnt mit der Koordination von TMA an meso-IHf zur Bildung von L2ClHf(μ-Cl)AlMe3 und dem anschließenden Austausch einer Methylgruppe zur Bildung von L2ClHf(μ-Me)AlMe2Cl. Obwohl, wie erwähnt, DFT-Rechnungen zeigten, dass die chloridsubstituierte Spezies gegenüber der methylierten energetisch leicht bevorzugt ist, zeigen die aus der kinetischen 1H NMR-Studie gewonnenen Daten deutlich, dass die Reaktion über die methylverbrückte Spezies verläuft. Die Triebkraft der Reaktion stammt daher wahrscheinlich vom Entziehen dieser Spezies aus dem Gleichgewicht L2ClHf(μ-Cl)AlMe3/L2ClHf(μ-Me)AlMe2Cl. Das Komplex/TMA-Addukt war stabil genug, um im entsprechenden LIFDI-Massenspektrum nachgewiesen zu werden (Abbildung 5). Dies war eine interessante Beobachtung in Anbetracht dessen, dass diese Art von Wechselwirkungen normalerweise als dynamisch und kurzlebig angesehen werden.17 Die Nachweisbarkeit dieses Addukts mittels LIFDI-MS weist darauf hin, dass die μ-Me-Koordination besonders stabil ist. Wir stellten daher die Hypothese auf, dass die für eine Isomerisierung notwendige Spaltung der Hf−Cp-Bindung durch die Koordination eines zweiten Substituenten vom Al-Atom zum Hf-Zentrum ermöglicht werden könnte, um ein doppelt überbrücktes LClHf(μ-Cl)(μ-Me)AlMe2 hochenergetisches Zwischenprodukt zu bilden, wie in Schema 3 dargestellt. Die Abgabe zusätzlicher Elektronendichte an das zentrale Metallatom sollte die formal kationische Ladung bei der Ablösung des Cp-Liganden teilweise kompensieren. Von diesem Zwischenprodukt aus könnte der Ligand frei rotieren und anschließend wieder an das zentrale Metallatom gebunden werden, um das thermodynamisch bevorzugte racemische Isomer zu bilden. Ein ähnlicher Mechanismus wurde in der Literatur vorgeschlagen.7a DFT-Rechnungen belegten die Möglichkeit eines solchen energiereichen Zwischenprodukts für den Komplex IIHf, dessen Bildung mit 160 kJ/mol endergonisch ist. Optimierungsversuche einer analogen doppelt verbrückten L2ClHf(μ-Cl)(μ-Me)AlMe2-Spezies, bei der beide Cp-Liganden noch an das zentrale Metallatom gebunden sind, schlugen fehl und führten in allen Fällen zu L2ClHf(μ-Cl)AlMe3, was die Notwendigkeit der Ablösung eines Cp-Liganden belegt. Die geometrieoptimierte Struktur dieses hochenergetischen Zwischenprodukts ist in Abbildung 6 dargestellt.
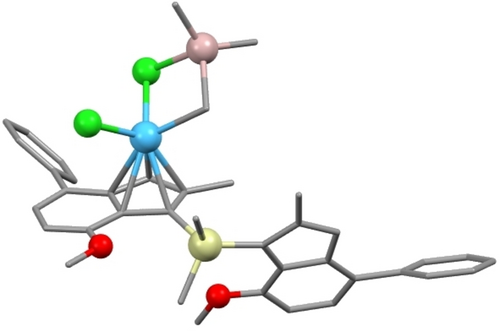
Geometrieoptimierte Struktur des hochenergetischen Zwischenprodukts von IIHf nach Reaktion mit TMA und Ablösung eines Liganden.
Die Methylierung der meso Isomere der Komplexe III–V (M: Zr, Hf) ohne Methoxygruppen wurde ebenfalls beobachtet. Die Reaktionen stoppten jedoch bei den methylierten Komplexen und es fand keine Isomerisierung statt. Im Einklang mit diesen Beobachtungen steht die erhöhte Endergonizität von 196 kJ/mol für die Bildung des analogen hochenergetischen Zwischenprodukts des Komplexes IIIHf aus seiner Stammverbindung. Der höhere Energieunterschied von 36 kJ/mol im Vergleich zu IIHf unterstreicht erneut die Notwendigkeit und Rolle der Methoxygruppen bei der durch Aluminiumalkyl induzierten Isomerisierung der untersuchten Gruppe IV Metallocenkomplexe.
Zusammenfassung und Ausblick
Zusammenfassend haben wir den Anwendungsbereich unserer zuvor beschriebenen Isomerisierung des Hafnocenkomplexes meso-IHf auf Metallocenkomplexe mit verschiedenen Ligandengerüsten und Zirkonocen/MAO-Systemen verbessert und erweitert. So konnten wir meso Metallocenkomplexe – die im Allgemeinen als Abfall gelten – nutzen, um isotaktisches Polypropylen mit makromolekularen Eigenschaften herzustellen, die denen von iPP entsprachen, das aus den entsprechenden reinen racemischen Isomeren hergestellt wurde. Dies ermöglichte eine Steigerung der iPP Ausbeute pro Mol des für die Metallocensynthesen verwendeten Liganden um bis zu 400 %.
Durch schrittweise Variation der Substituenten an den Indenyleinheiten der Liganden konnten wir die Methoxysubstituenten an Position 7 als entscheidenden Faktor für eine Isomerisierung identifizieren. DFT-Berechnungen zeigten, dass die Energien, die zur Anpassung der jeweiligen Ligandenkonformationen in Gegenwart dieser Substituenten erforderlich sind, um bis zu 19 kJ/mol abweichen. Liganden ohne Methoxygruppen zeigten in beiden Konformeren keine energetischen Unterschiede und daher wird klar, dass die Triebkraft der Isomerisierung in diesen energetischen Diskrepanzen liegt. Basierend auf den Ergebnissen aus 1H- und 29Si NMR-, sowie LIFDI-MS-Experimenten haben wir einen Mechanismus der TMA-induzierten Isomerisierung vorgeschlagen. Dieser Mechanismus beinhaltet ein Zwischenprodukt, das durch eine μ-Me- und μ-Cl-Wechselwirkung von TMA mit dem zentralen Metallatom stabilisiert wird. Ausgehend von diesem Zwischenprodukt kann eine Rotation eines Indenylliganden zur Bildung des entsprechenden racemischen Isomers stattfinden. Der vorgeschlagene Mechanismus sollte die methylierten Verbindungen meso-IHfMe und rac-IHfMe als Zwischenprodukte bilden und beide wurden tatsächlich experimentell nachgewiesen. Darüber hinaus wurden zwei weitere denkbare Isomerisierungs-wege mithilfe von DFT-Berechnungen ausgeschlossen, was den vorgeschlagenen Mechanismus untermauert. Die einfache und effektive Isomerisierung von 7-Methoxy-substituierten Gruppe IV Metallocenkomplexen – in Kombination mit ihren hervorragenden Polymerisationseigenschaften – sollte das zukünftige Design dieser Katalysatorklasse in Richtung einer energie- und atomeffizienten Polyolefinökonomie lenken.
Die Autoren haben zusätzliche Referenzen in der Hintergrundinformationen zitiert.18-22, 23-32
Danksagung
Die Autoren danken Patricia Aufricht, Cara Bommer und Ruocheng Tang für ihre Hilfe bei den Metallocensynthesen. Darüber hinaus danken sie Dr. Lucas Stieglitz und Magdalena Kleybolte für das Korrekturlesen des Manuskripts, sowie Dr. Sergei Vagin, Dr. Sven Krüger und Patrick Mollik für wertvolle Diskussionen. Die Autoren danken weiterhin dem Leibniz-Supercomputerzentrum (www.lrz.de) für die Rechen- und Datenressourcen, die sie zur Verfügung gestellt haben. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
SC-XRD Daten sind verfügbar unter www.ccdc.cam.ac.uk/products/csd mit den deposition numbers 2308439 (rac-VHf) und 2308440 (rac-IIZr).33




