Die entscheidende Rolle von Sb2F10 bei der chemischen Synthese von F2
Abstract
Die Synthese von elementarem Fluor auf rein chemischem Weg ist spektakulär und galt länger als ein Jahrhundert als unmöglich. Im Jahr 1986 war man schließlich erfolgreich. Seitdem wurde diese wichtige Reaktion nicht weiter untersucht und ihr detaillierter Mechanismus blieb ein Rätsel. Die ursprüngliche Hypothese eines thermodynamisch instabilen MnF4, welches sich spontan zu einem Manganfluorid niedrigerer Oxidationsstufe und elementarem Fluor zersetzt, wird durch die bekannte thermische Stabilität von MnF4 in Frage gestellt. Diese scheinbare Diskrepanz konnte nun experimentell und durch quantenchemische Rechnungen aufgeklärt werden. Die reduktive Eliminierung von F2 aus MnF4 erfordert einen großen Überschuss an SbF5. Sie findet im letzten Reaktionsschritt statt, wenn sich an das Zwischenprodukt [SbF6][MnF2][Sb2F11] ein weiteres SbF5-Molekül unter Bildung eines weiteren tridentaten [Sb2F11]−-Anions anlagert. Die beiden [Sb2F11]−-Anionen stellen dem Mn-Atom so sechs verbrückende F-Atome zur Verfügung und ermöglichen damit die reduktive Eliminierung der beiden terminalen Fluoridoliganden als F2.
Einleitung
 (1)
(1)Die Reaktion von K2[MnF6] mit SbF5 lief bei Zimmertemperatur nicht in nennenswertem Umfang ab, aber beim Erhitzen auf 150 °C wurde das gelbe K2[MnF6] dunkelblau, was die Bildung von MnF4 anzeigte. Zudem setzte unmittelbar eine Gasentwicklung ein. In den Hintergrundinformationen findet sich davon eine Photographie. Christe nahm daher die thermodynamische Instabilität des MnF4 unter den gegebenen Bedingungen und seine Zersetzung zu MnF3 und einem halben Äquivalent F2 an. Das gebildete Gas wurde aufgefangen, über Druck und Volumen bei gegebener Temperatur quantifiziert und durch Umsetzung mit Hg als elementares Fluor identifiziert. Allerdings wurden die bei der Reaktion anfallenden Feststoffe und der Reaktionsmechanismus nicht untersucht. Die Annahme der thermodynamischen Instabilität von MnF4 und die Bildung von MnF3 standen mit mehreren Beobachtungen im Widerspruch. Bei MnF4 handelt es sich um eine stabile Verbindung,13-18 die sich erst oberhalb von 320 °C zu festem MnF2 und gasförmigem F2 zersetzt.14, 18 Zudem wurde über stabile Addukte unterschiedlicher Zusammensetzung von SbF5 und MnF4 berichtet.15 Zur Klärung dieser scheinbar widersprüchlichen Ergebnisse haben wir nun die chemische Synthese von elementarem Fluor erneut untersucht, um zuverlässigere Aussagen über den genauen Verlauf dieser sehr wichtigen Reaktion zu erhalten.
Ergebnisse und Diskussion
Ultramarinblaues β-MnF4-Pulver wurde bei Zimmertemperatur mit einem großen Überschuss an farblosem, flüssigem SbF5 in einem Reaktionsgefäß aus FEP umgesetzt. Mit bloßem Auge beobachtete man dabei die Entwicklung kleiner Gasblasen und die Entfärbung des MnF4. Diese Farbänderung war ein starker Hinweis auf die Bildung einer farblosen MnII- statt einer violett-blauen MnIII-Verbindung. Nach sechstägiger Aufbewahrung bei Zimmertemperatur hatten sich einige farblose Kristalle gebildet, die in Anzahl und Größe über weitere 30 Tage Reaktionszeit bei Zimmertemperatur zunahmen. Auch nach 36 Tagen lag noch immer etwas nicht-umgesetztes ultramarinblaues MnF4 vor. In Gegenwart von SbF5 läuft also die Zersetzung von MnF4 zu F2 bei Zimmertemperatur ab, jedoch nur äußerst langsam. Nachdem das überschüssige SbF5 bei −78 °C ausgefroren wurde, leitete man die verbliebende Gasphase über KI-Pulver. Das weiß erscheinende Pulver wurde aufgrund der Oxidation von I− zu I2 schlagartig braun, was die Bildung von F2 in der Reaktion von MnF4 mit SbF5 belegt. Eine Photographie findet sich in den Hintergrundinformationen.
 (2)
(2) (3)
(3)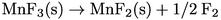 (4)
(4)
 (5)
(5)
Allerdings wird die Zersetzung in Gegenwart der starken Lewis-Säure SbF5 eingeleitet. Da Sb2F10 eine noch stärkere Lewis-Säure als SbF5 ist31, 32 und das [Sb2F11]−-Anion als tridentater Ligand agiert, ist es nicht überraschend, dass die [Sb2F11]−-Salze die bevorzugten Produkte in Gegenwart eines großen Überschusses an SbF5 sind. Es stellt sich dann die Frage, welche Reaktionsschritte der Umsetzung von MnF4 mit SbF5 zur Entwicklung des elementaren Fluors führen. Sawodny und Rau hatten gezeigt,15 dass SbF5 stabile, fluorverbrückte Addukte mit MnF4 bilden kann. Sie hatten jedoch nie die Freisetzung von Fluor beobachtet.
Die Kristallstruktur von Mn[Sb2F11]2
Mn[Sb2F11]2 ist mit der bekannten und ebenso farblosen Verbindung Mn[SbF6]2 verwandt. Letztere wird direkt aus der Umsetzung von MnF2 mit SbF5 in SO2- oder aHF-Lösung erhalten.33, 34 Mn[Sb2F11]2 kristallisiert im triklinen Kristallsystem, Raumgruppe P (Nr. 2), mit den Gitterparametern a=5.2714(4), b=8.2592(5), c=10.3168(7) Å, α=66.547(5), β=76.893(5), γ=87.029(5)°, V=400.95(5) Å3, Z=1, T=100 K, Pearson-Symbol aP27. Nach unserem Kenntnisstand handelt es sich dabei um einen neuen Strukturtyp. Weitere Details der Strukturbestimmung, die Atomkoordinaten, die isotropen und anisotropen Auslenkungsparameter finden sich in den Hintergrundinformationen, Tabellen S1 bis S3.
(Nr. 2), mit den Gitterparametern a=5.2714(4), b=8.2592(5), c=10.3168(7) Å, α=66.547(5), β=76.893(5), γ=87.029(5)°, V=400.95(5) Å3, Z=1, T=100 K, Pearson-Symbol aP27. Nach unserem Kenntnisstand handelt es sich dabei um einen neuen Strukturtyp. Weitere Details der Strukturbestimmung, die Atomkoordinaten, die isotropen und anisotropen Auslenkungsparameter finden sich in den Hintergrundinformationen, Tabellen S1 bis S3.
Die Verbindung enthält zweikernige [Sb2F11]−-Anionen und Mn2+-Kationen. Letztere sind oktaeder-ähnlich von den F-Atomen der Anionen umgeben (Abbildung 1). Sowohl die Mn- als auch die Sb-Atome sind über ihre Koordinationspolyeder eckenverknüpft. Die Sb-F-Abstände der terminal gebundenen F-Atome (Ft4-6 und Ft7-10) liegen im Bereich von 1.833(4) bis 1.842(3) Å. Die Fluoridverbrückung der Sb-Atome im [Sb2F11]−-Anion ist asymmetrisch, wobei die Länge der Sb(1)-Fμ(11)-Bindung 1.975(3) Å und die der Sb(2)-Fμ(11)-Bindung 2.083(3) Å beträgt. Dieser Unterschied wird dadurch hervorgerufen, dass das Sb(1)-Atom von drei zu Mn- verbrückenden F-Atomen umgeben ist, wohingegen es am Sb(2)-Atom nur zwei sind. Aufgrund der Lage des Mn-Atoms im Inversionszentrum gibt es nur drei verschiedene Mn-F-Bindungslängen, diese betragen 2.093(3), 2.108(3) und 2.128(3) Å. Die beiden kürzeren Bindungen sind innerhalb ihrer verdreifachten Standardunsicherheiten gleich, wohingegen die dritte etwas abweicht. Insgesamt passen diese Mn-F-Abstände zu denen die man von anderen MnII-Fluoriden kennt.34 Bei MnIII- oder MnIV-Fluoriden sind die Mn-F-Abstände deutlich kürzer, was sich aus der höheren Ladung der Mn-Atome ergibt.28, 35, 36 Ausgewählte Atomabstände sind in Tabelle S4 aufgeführt.
Der Ausschnitt aus der Kristallstruktur von Mn[Sb2F11]2 zeigt ein [Sb2F11]−-Anion und seine Verknüpfung zu einem MnII-Ion. Die Auslenkungsellipsoide sind bei 70 % Wahrscheinlichkeit bei 100 K gezeigt. Gestrichelte Bindungen deuten die Verknüpfung zu weiteren Anionen bzw. Kationen an.
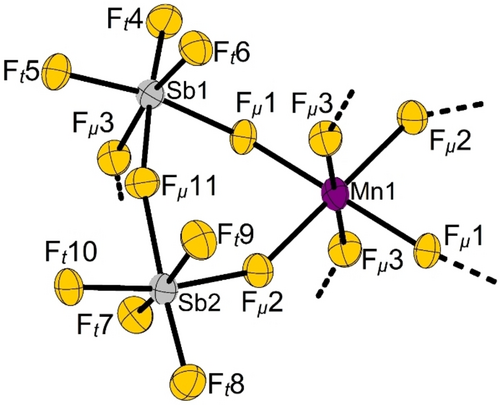
Die sechs F-Atome, die das Mn-Atom oktaeder-ähnlich koordinierenden, gehören zu insgesamt vier [Sb2F11]−-Anionen. Zwei der Anionen sind als bidentate Liganden gebunden und stellen die vier F-Atome (2×Fμ(1), 2×Fμ(2)) einer gedachten äquatorialen Ebene des MnF6-Oktaeders zur Verfügung. Die anderen beiden [Sb2F11]−-Anionen liefern die beiden F-Atome der gedachten apikalen Positionen (2×Fμ(3)) und verknüpfen selbst noch zu weiteren Mn-Atomen. So entstehen eindimensional-unendliche Stränge aus Anionen und Kationen, die parallel zur a-Achse verlaufen, siehe Abbildung 2.
Die Kristallstruktur von Mn[Sb2F11]2 mit Blick entlang der a-Achse. Die eindimensional-unendlichen Stränge aus Anionen und Kationen erstrecken sich zum Betrachter hin und von ihm weg. Die Atome sind mit willkürlichen Radien isotrop dargestellt.
 (6)
(6)Die Addition der Zähler in den spitzen Klammern ergibt die Koordinationszahl des jeweiligen Zentralatoms, hier sechs in allen Fällen. Die Addition der Summanden in den Nennern gibt die Koordinationszahl des jeweiligen Liganden an. Eine Summe von „1“ steht für ein terminal gebundenes Atom, die Summe „2“ für ein μ-verbrückendes Atom und die Summe „3“ stünde für ein μ3-verbrückendes Atom. Die Reihenfolge der Summanden zeigt, welches der Zentralatome in die Verknüpfung involviert ist, erster Summand, erste spitze Klammer, usw.38
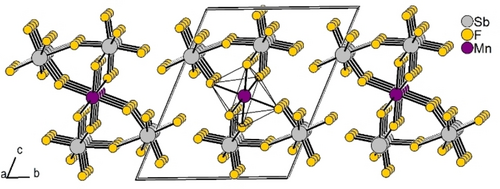
Unsere Versuche Einkristalle vom postulierten Zwischenprodukt [SbF6][MnF2][Sb2F11] zu erhalten sind bislang gescheitert. Seine auf DFT-Niveau vorhergesagte Gasphasenstruktur findet sich in Abbildung 3, wo ein sechsfach koordiniertes Mn-Atom durch zwei terminal gebundene F-Atome, durch drei Fluorbrücken eines [Sb2F11]−-Anions und durch eine einzelne Fluorbrücke eines [SbF6]−-Anions stabilisiert wird.
Die vorhergesagte Gasphasenstruktur von [SbF6][MnF2][Sb2F11] mit Bindungslängen in Å.
Quantenchemische Rechnungen
Um zu klären, wie die Reaktion ablaufen könnte, wurden quantenchemische Rechnungen durchgeführt. Zunächst wurden Bildungswärmen der verschiedenen MnFn-Spezies für die Gasphase auf dem FPD-Niveau39-42 (Feller, Peterson, Dixon) berechnet, wobei sowohl HF-Orbitale (Hartree Fock) als auch mit dem PW91-Funktional43, 44 berechnete DFT45-Orbitale46 verwendet wurden. Die Ergebnisse sind in Tabelle 1 zusammengefasst und stimmen mit den experimentell ermittelten Werten30 überein, wenn man deren Fehler in Betracht zieht.
MnFn |
Spin sym. |
ΔHf0(g) HF[a] |
ΔHf0(g) PW91[b] |
ΔHf0(g) expt.[c] |
ΔHf0(s) expt.[c] |
C. E.[d] |
|---|---|---|---|---|---|---|
MnF |
7C∞v |
−20.2 |
−20.6 |
−19.9±3 |
|
|
MnF2 |
6D∞h |
−130.2 |
−131.2 |
−126.2±1 |
−202.4 |
71 |
MnF3 |
5C2v |
−180.5 |
−184.0 |
−188±14 |
−256±14 |
72±14 |
MnF4 |
4C2v |
−212.0 |
−220.4 |
−231±17 |
−265±17 |
45±17 |
- [a] FPD, HF orbitals. [b] FPD, PW91 orbitals. [c] Ref. [30]. [d] C. E.=Cohesive Energy.
Die Übereinstimmung der auf HF- und PW91-Niveau berechneten Werte nimmt mit zunehmender Anzahl an Fluoratomen und dem Wechsel der Oxidationsstufen der Mn-Atome ab.
Die berechneten Energien für die Gasphase für Reaktion 4 betragen 52.8 (FPD, PW91-Orbitale) und 50.3 kcal/mol (FPD, HF-Orbitale), für Reaktion 5 ergeben sich 89.2 (FPD, PW91-Orbitale) und 81.8 kcal/mol (FPD, HF-Orbitale). Für Reaktion 4 ist die Reaktionsenthalpie für die Gasphase ungefähr genauso groß wie die für die Feststoffe. Die Sublimationsenthalpie einer Spezies wird als Differenz zwischen den Enthalpien für die Gasphase und dem festen Zustand angegeben. Für MnF2 und MnF3 sind die Sublimationsenthalpien ungefähr gleich und somit auch die Reaktionsenthalpien für die Gasphasen- und Festphasenreaktionen. Die Sublimationsenthalpie von MnF4 ist viel kleiner als die von MnF2, hat aber einen großen Fehler. Für Reaktion 5 ist der Wert für die Gasphase größer als für die feste Phase und liegt auch außerhalb des Fehlers von circa 10 kcal/mol. Die Gasphasenwerte sagen daher die Bildungswärmen für die Feststoffe nur qualitativ voraus. Für einige ausgewählte ungeladene Spezies wurden auch die freien Solvatationsenergien in CCl4 abgeschätzt, indem ein selbstkonsistenter Reaktionsfeldansatz47 (COSMO)48, 49 verwendet wurde. Da die so erhaltenen Werte allesamt kleiner als 10 kcal/mol sind, beeinflussen sie die Gesamtenergien der Reaktionen nicht wesentlich.
Da bei den relevanten Reaktionen mit SbF5 und Sb2F10 offenschalige Mn-Spezies beteiligt sind, konnten die Reaktionsenergien nur auf DFT-Niveau vorhergesagt werden.45 Für die DFT-Rechnungen wurde das B3LYP-Funktional50, 51 eingesetzt, da es eine angemessene, jedoch keine chemisch exakte Übereinstimmung (±1 kcal/mol) mit Rechnungen auf CCSD(T)/aug-cc-pVDZ-PP-Niveau lieferte. Die Reaktionsenergien für die Schlüsselschritte zweier möglicher Reaktionsmechanismen A und B sind in Tabelle 2 gezeigt.
Reaktions- Nr. |
Reaktion |
Spin Reaktand |
Spin Produkt |
ΔH298K |
|---|---|---|---|---|
|
Mechanismus A |
|||
6 |
MnF4+SbF5→[MnF3]+[SbF6]− |
4 |
4 |
−27.5 |
7 |
[MnF3]+[SbF6]−+SbF5→[MnF2][SbF6]2 |
4 |
6 |
25.7 |
8 |
[MnF2][SbF6]2+SbF5→[SbF6][MnF2][Sb2F11] |
6 |
6 |
−13.6 |
9 |
[SbF6][MnF2][Sb2F11]+SbF5→Mn[Sb2F11]2+F2 |
6 |
6 |
4.9 |
6+7+8+9 |
MnF4+4 SbF5→Mn[Sb2F11]2+F2 |
4 |
6 |
−10.5 |
|
|
|||
|
Mechanismus B |
|||
10 |
MnF4+SbF5→[MnF3]+[SbF6]− |
4 |
4 |
−27.5 |
11 |
[MnF3]+[SbF6]−+SbF5→[MnF2][SbF6]2 |
4 |
6 |
25.7 |
12 |
[MnF2][SbF6]2→Mn[SbF6]2+F2 |
6 |
6 |
29.0 |
10+11+12 |
MnF4+2 SbF5→Mn[SbF6]2+F2 |
4 |
6 |
27.2 |
Unter Bildung der beobachteten Produkte Mn[Sb2F11]2 und F2 ist die Gesamtreaktion von vier SbF5-Molekülen mit MnF4 mit 10.5 kcal/mol exotherm im Reaktionsmechanismus A (Reaktionsgleichungen 6+7+8+9). Im Gegensatz dazu ist die Gesamtreaktion (Reaktionsgleichungen 10+11+12) nach Mechanismus B, wo lediglich zwei Moleküle SbF5 gebraucht werden, mit 27.2 kcal/mol endotherm. Die Beschreibung der Reaktion nach Mechanismus A ist somit klar zu bevorzugen. Die Rechnungen zeigen zudem, dass die F2-Eliminierung nicht auftritt, wenn monomeres SbF5 verwendet wird, und dass die stärkere Lewis-Säure Sb2F10 (pF− von SbF5=11.30, der von Sb2F10=12.69)31 essentiell für den Verlauf der Reaktion ist.
Beim ersten Schritt von Mechanismus A, Reaktion 6, handelt es sich um den exothermen Transfer eines F−-Ions von MnF4 auf SbF5 unter Bildung des Ionenpaars [MnF3]+[SbF6]−. Man beachte, dass die Reaktion zur Bildung der beiden separierten Ionen in der Gasphase mit 139 kcal/mol stark endotherm ist. Die für dieses Ionenpaar abgeschätzte Gitterenergie52, 53 beträgt 124 kcal/mol, daher wird das freie Ionenpaar hauptsächlich durch die Coulomb-Wechselwirkung stabilisiert. Die abgeschätzte Gitterenergie für [MnF3][Sb2F11] beträgt zum Vergleich 111 kcal/mol. Der zweite Schritt, Reaktion 7, ist die Addition eines zweiten SbF5-Moleküls begleitet von einer erneuten F−-Abstraktion unter der Bildung von [MnF2][SbF6]2. Hierbei handelt es sich um den endothermsten Schritt im Mechanismus A, der aber durch die Exothermie des ersten Schritts in Reaktion 6 ausgeglichen wird. Im nächsten Schritt, Reaktion 8, addiert ein drittes SbF5-Molekül an das Intermediat [MnF2][SbF6]2 unter exothermer Bildung von [SbF6][MnF2][Sb2F11]. Im letzten, leicht endothermen Schritt, Reaktion 9, addiert das vierte SbF5-Molekül unter gleichzeitiger Eliminierung von F2, so dass MnIV zu MnII reduziert wird. Die leicht endotherme Reaktion könnte dafür verantwortlich sein, warum die Reaktion bei Zimmertemperatur so langsam und unvollständig abläuft. Das Mn-Atom im molekularen MnF4 ist zu Beginn vierfach koordiniert. Mit der Bindung des ersten SbF5-Moleküls nimmt es dann die Koordinationszahl sechs an, und behält diese im weiteren Reaktionsverlauf bei, wie weiter unten noch näher erläutert wird. Durch die Verwendung anderer DFT-Funktionale, siehe weiterführende Informationen, können zwar noch exothermere Verläufe für die Gesamtreaktion errechnet werden, diese stehen aber dennoch mit obigen Schlussfolgerungen im Einklang.
Wenn für die Erzeugung von F2 aus MnF4 nur zwei SbF5-Moleküle zu Verfügung stehen, was der Gesamtreaktion nach Mechanismus B (Reaktionen 10+11+12) entspricht, so wäre diese ausgeprägt endotherm, siehe Tabelle 2. Der Vergleich der beiden Reaktionsmechanismen A und B verdeutlicht die Notwendigkeit eines Überschusses an SbF5, da das Endprodukt durch die zusätzliche Bindung des [SbF6]−-Liganden an ein SbF5-Molekül stabilisiert wird. So wird die Fluoridionenaffinität von SbF5 deutlich erhöht, und der F−-Ionentransfer vom Mn-Atom erleichtert. Diese Ergebnisse stehen im Einklang mit der Notwendigkeit eines Überschusses an SbF5 im eigentlichen Experiment. Darüber hinaus stimmen die Ergebnisse auch mit der Beobachtung der kristallinen Verbindung Mn[Sb2F11]2 überein. Hier ist die Situation jedoch komplexer, da sie auch mit dem Löslichkeitsprodukt (L) des Feststoffs im SbF5 zusammenhängt. Wir haben auch andere mögliche Reaktionsabläufe untersucht. Beispielsweise ist die Addition von Sb2F10 an MnF4 zur Bildung von [MnF3]+[Sb2F11]− zwar exotherm (−26.7 kcal/mol), aber die Addition des dritten SbF5-Moleküls zur Bildung von [SbF6][MnF2][Sb2F11] ist endothermer (40.5 kcal/mol), was diesen Weg weniger günstig macht (siehe weiterführende Informationen).
In der Zusammenschau aller experimentellen und quantenchemischen Ergebnisse erscheint Mechanismus A als am konsistentesten für die Beschreibung der Reaktion mit der durch SbF5 getriebenen Reduktion von MnIV zu MnII als die wahrscheinliche Quelle der F2-Entwicklung. Da die Zersetzung von MnF4 zu MnII und F2 eher langsam verläuft, muss wenigstens einer der Zwischenschritte der Zersetzung eine deutliche Aktivierungsbarriere aufweisen, was mit dem energetisch etwas ungünstigen Schritt von Reaktion 9 in Mechanismus A übereinstimmt. Die Auswirkung der starken Lewis-Säure SbF5 auf die chemische Fluorsynthese ist analog zu unserer früheren Feststellung, dass SbF5 die Elektronenaffinität von F2 um 6.7 eV erhöht, wodurch es zum stärksten neutralen Ein-Elektronen-Oxidationsmittel wird.32
Dieser Verstärkungseffekt ist zum Teil auf die innere Koordinationssphäre des Mn-Zentrums zurückzuführen. Das MnIV-Atom des Zwischenprodukts [SbF6][MnF2][Sb2F11] wird durch sechs Fluor-Wechselwirkungen stabilisiert: Drei F-Atome stammen vom tridentaten [Sb2F11]−-Anion, eines vom [SbF6]−-Anion und die beiden verbliebenen von den terminal gebundenen F-Atomen. Die Addition eines weiteren SbF5-Moleküls an [SbF6]− wandelt es zu einem zweiten tridentaten [Sb2F11]−-Anion um, so dass sechs F-Wechselwirkungen von den beiden [Sb2F11]−-Anionen zur Verfügung gestellt werden können. In der Kristallstruktur von Mn[Sb2F11]2 stammt die dritte F-Brücke eines [Sb2F11]−-Anions nicht von demselben Sb-Atom wie die ersten beiden Brücken, stattdessen kommt sie von einem benachbarten [Sb2F11]−-Anion des gleichen Strangs. In unserer quantenchemischen Rechnung sind keine benachbarten [Sb2F11]−-Anionen vorhanden, daher kommen alle drei Brücken vom selben [Sb2F11]−-Anion. Da nun das MnIV-Atom nur durch die beiden [Sb2F11]−-Anionen schon eine günstige Koordinationszahl von sechs erreicht hat, werden nun seine beiden verbliebenen, terminal gebundenen F-Atome als F2 in einer reduktiven Fluor-Eliminierung freigesetzt wodurch MnIV wird zu MnII wird. Summa summarum findet die reduktive Fluor-Eliminierung im letzten Schritt statt, bei dem das letzte SbF5-Molekül an [SbF6]− bindet, was auch den notwendigen Überschuss an SbF5 erklärt.
Zusammenfassung
Die faszinierende chemische Synthese von elementarem Fluor wurde sowohl experimentell als auch durch quantenchemische Rechnungen untersucht. Es wurde gezeigt, dass die Verwendung eines großen Überschusses an SbF5, der das Auftreten von Sb2F10 in ausreichender Konzentration im Gleichgewicht ermöglicht, eine entscheidende Rolle spielt, um die Reaktion bei moderaten Temperaturen ablaufen zu lassen, und dass sich MnF4 eben nicht, wie früher angenommen, spontan zu MnF2 und F2 bei Zimmertemperatur zersetzt. Das letztendliche Reaktionsprodukt neben dem entstanden F2 ist die Verbindung Mn[Sb2F11], welche isoliert und Anhand ihrer Kristallstruktur charakterisiert wurde.
Details zu den Experimenten und den quantenchemischen Berechnungen
Diese finden sich in den Hintergrundinformationen. CCDC-Nummer 2264176 enthält die weiterführenden kristallographischen Daten zu diesem Manuskript. Die gibt's kostenlos beim The Cambridge Crystallographic Data Centre.
Interessenskonflikte
Die Autoren erklären, dass keine Interessenskonflikte bestehen.
Danksagung
F. Kraus dankt Solvay für die freundliche Spende von Fluor, Prof. Dr. A. J. Karttunen, Aalto Universität, und Dr. Sergei Ivlev, Marburg, für hilfreiche Diskussionen. Die quantenchemischen Rechnungen wurden vom U.S. Department of Energy, Office of Science, Basic Energy Sciences, Chemical Sciences, Geosciences, and Biosciences Division, Catalysis Science Program, FWP 47319, im Rahmen eines Untervertrags zwischen dem Pacific Northwest National Laboratory und der University of Alabama unterstützt. D. A. Dixon dankt dem Robert Ramsay Fund der Universität von Alabama für die teilweise Unterstützung.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
No additional Research Data in a public repository is available.




