Mit sichtbarem Licht schaltbare Benzimidazol-Azo-Arene wirken als β-Arrestin2 funktionell selektive Cannabinoid-Rezeptor 2 Agonisten
Abstract
Der Cannabinoid 2 Rezeptor (CB2R) besitzt großes therapeutisches Potential bei zahlreichen pathophysiologischen Prozessen wie z. B. der Neuroinflammation. Signalweg-selektive Liganden werden benötigt, um mangelnden klinischen Erfolg zu überwinden und um die Zusammenhänge zwischen einzelnen Signalwegen und deren therapeutischen Effekten zu beleuchten. Hier berichten wir vom Design und der Synthese eines photoschaltbaren chemischen Gerüsts basierend auf der “privilegierten” Struktur des Benzimidazols und seiner Anwendung als funktionell selektiven CB2R “Wirksamkeitsschalter” (”efficacy switch”). Benzimidazol-Azo-Arene bieten großes Potential für eine breite Erweiterung der Photopharmakologie auf eine Vielzahl optisch adressierbarer biologischer Zielstrukturen. Wir haben dieses Gerüst verwendet, um Substanz 10 d zu entwickeln, ein “trans-on” Agonist, der als molekulare Sonde dient, um den β-Arrestin2 (βArr2) Signalweg am CB2R zu untersuchen. Die selektive Aktivierung des βΑrr2 Signalweges wurde mittels CB2R Internalisierung und βArr2 Rekrutierung nachgewiesen, während keine Aktivierung bei der Betrachtung von Gα16 oder mini-Gαi auftrat. Insgesamt stellt Substanz 10 d den ersten Licht-abhängigen funktionell selektiven Agonisten dar, mit dem die komplexen βArr2-abhängigen Mechanismen der Endozytose am CB2R untersucht werden können.
Einleitung
Das Endocannabinoid System (ECS) besteht aus G-Protein-gekoppelten Rezeptoren (GPCRs), insbesondere den Cannabinoid Rezeptor Subtypen 1 und 2 (CB1R und CB2R), deren endogenen Liganden und mehreren Enzymen, die an der Synthese und dem Abbau von Endocannabinoiden beteiligt sind.1 Der CB1R wird sehr stark im zentralen Nervensystem (ZNS) exprimiert, ist aber auch in peripheren Geweben wie Herz, Leber oder dem gastrointestinalem Trakt vorzufinden, wohingegen CB2R hauptsächlich in peripheren immunaktiven Organen und Zellen mit Immunfunktion, wie Milz, Mandeln, Leukozyten und Makrophagen, exprimiert wird.2 Es wurde beschrieben, dass die CB2R Expression sowohl in der Peripherie als auch im ZNS als Antwort auf eine Aktivierung des Immunsystems oder einer Entzündung induziert wird, ebenso in Mikroglia-Zellen, die Amyloid-β Plaques bei Morbus Alzheimer Patienten umgeben. Mikroglia – als die im ZNS ansässigen Makrophagen – exprimieren keine CB2Rs in ihrer nicht-stimulierten Form.2a, 3 Eine Verringerung von Mikroglia-vermittelter Neurotoxizität aufgrund der Freisetzung von pro-inflammatorischen Zytokinen konnte durch die Anwendung von selektiven CB2R Agonisten erreicht werden.4 Darüber hinaus wurde beobachtet, dass CB2R Agonismus eine Mikroglia-Migration verursacht, was die Phagozytose von Amyloid-β Plaques steigert.4, 5
Das ECS besitzt therapeutisches Potential bei zahlreichen Erkrankungen. Insbesondere wurde gezeigt, dass der CB2R eine wichtige Rolle bei der Pathogenese von inflammatorischen oder neuropathischen Schmerzen spielt, sowie bei neurodegenerativen Erkrankungen wie Morbus Alzheimer, Autoimmunerkrankungen und verschiedenen Krebsarten.6 Aktuell adressieren mehr als 30 % aller durch die US Food and Drug Administration (FDA) zugelassenen Medikamente GPCRs.7 Allerdings führte bislang die Targetierung des CB1R und des CB2R nicht zum gewünschten therapeutischem Erfolg. Die Komplexität des ECS und dessen Beteiligung an zahlreichen physiologischen Prozessen, sowie Funktionen wie Gedächtnis, Appetit, Immunfunktion, Schmerzmodulation und Neuroprotektion, um einige wenige zu nennen, macht es schwierig, einen gewünschten therapeutischen Effekt zu erzielen ohne gleichzeitig Nebenwirkungen zu erzeugen.8 Das bekannteste Beispiel eines gescheiterten CBR-Therapeutikums ist vermutlich der CB1R-selektive inverse Agonist Rimonabant, welcher 2006 von der FDA als Medikament gegen Adipositas zugelassen wurde und dann 2008 aufgrund von psychiatrischen Nebenwirkungen wieder vom Markt genommen werden musste.8c, 9 Das therapeutische Interesse hat sich seitdem in Richtung CB2R verschoben. Eine Selektivität von Cannabinoid Liganden für CB2R über CB1R ist wünschenswert, um die bekannten psychoaktiven Effekte des (−)-trans-Δ9-Tetrahydrocanabinols zu vermeiden, die durch den CB1R Agonismus entstehen.10 CB2R-selektive Agonisten sind nicht psychoaktiv und verursachen weniger Nebenwirkungen aufgrund der begrenzten CB2R Expression im ZNS.6b, 6c
Noch ist zu wenig über die pharmakologischen Aspekte der CB2R-vermittelten Signalwege sowohl in gesunden als auch in pathologischen Prozessen bekannt. CB2R Liganden weisen große strukturelle Variabilität auf und zeigen ausgesprochen heterogene Signalprofile. Viele solcher Liganden, insbesondere Endocannabinoide, zeigen ein Signalweg-bevorzugendes Verhalten. Dieses Phänomen wird als „funktionell selektive Signalweg-Aktivierung“ (“biased signalling”) bezeichnet und kann entsprechend eine funktionell selektive Antwort verursachen.11 Endocannabinoide zeigen eine Bevorzugung für die G-Protein Aktivierung während sie keine bis schwache Wirkung hinsichtlich βArr-Rekrutierung besitzen.12 Diese große Diskrepanz der Signaltransduktion könnte eine Erklärung für das bisherige Versagen vieler CB2R Liganden in klinischen Studien liefern und unterstreicht die Bedeutung funktionell selektiver CB2R Liganden.12b, 13 Während der G-Protein-Signalweg gut untersucht ist, ist deutlich weniger über die Funktion von βArr am CB2R bekannt.14 Kürzlich wurde die βArr2 Rekrutierung am CB2R mit Toleranzentwicklung in Verbindung gebracht, während analgetische Effekte in einem Osteoarthritis-Modell gezeigt wurden.15 Insgesamt ist der pharmakologische Einfluss der βArr Rekrutierung am CB2R noch nicht vollständig aufgeklärt und weitere Untersuchungen sind vonnöten, um die Rolle der βArr Aktivierung hinsichtlich ihres therapeutischen Potentials oder bzgl. Nebenwirkungen zu beurteilen.
Licht- (oder photo)schaltbare Substanzen bieten das Potential, als wertvolle Werkzeuge zur Untersuchung von pharmakologischen Prozessen auf Rezeptorebene zu dienen, und haben sich bereits als höchst nützlich in der Medizinischen Chemie und Molekularbiologie erwiesen. Photopharmakologisch aktive Substanzen ermöglichen optische Kontrolle über ihren Ziel-Rezeptor oder -Enzym, wobei externes Licht eingesetzt wird. Solche photoschaltbaren Liganden isomerisieren bei Bestrahlung mit bestimmten Wellenlängen, sodass sie als reversible “Schalter” fungieren, idealerweise zwischen einem inaktiven und aktiven (Photo−)Isomer, was eine präzise zeitlich-räumliche Kontrolle über die Rezeptor-Aktivierung erlaubt.16 Es sind große Fortschritte beim Einsatz derartiger photoschaltbarer Substanzen zu verzeichnen, um erfolgreich die pharmakologischen Prozesse an GPCRs zu untersuchen, inklusive Klasse A dopaminerger,17 serotonerger-,18 adrenerger,19 und muskarinerger Rezeptoren20 sowie CBRs,21 und verschiedener Klasse B und C GPCRs.22 Signalweg-spezifische photoschaltbare Werkzeug-Verbindungen wären insbesondere nützlich, um spezifische Signalwege und ihre biologische Antwort vollständig zu verstehen. Unseres Wissens wurde bislang nur ein funktionell selektiver photoschaltbarer Ligand in der Literatur beschrieben. Broichhagen et al. haben ”LirAzo” entwickelt, ein photoschaltbares Inkretin-Mimetikum mit Photoisomer-abhängiger funktionell selektiver Signalweg-Aktivierung. Während cis-LirAzo die Zyklo-Adenosin-Monophosphat-Produktion signifikant stärker als das trans-Photoisomer steigert, induziert trans-LirAzo bevorzugt Ca2+-Signalwege.22b Eine zeitkontrollierte optische Aktivierung eines spezifischen CB2R Signalweges mit einem funktionell selektiven Liganden bedeutet einen großen Schritt in Richtung der Identifizierung des therapeutischen Potentials oder der Gefahr von Nebenwirkungen, die mit diesem Signalweg in Zusammenhang stehen. Ein βArr-funktionell selektiver photoschaltbarer Ligand könnte daher dazu beitragen, die potentiell mit dem βArr Signalweg in Verbindung gebrachten unerwünschten Wirkungen zu ergründen. Die Einsichten, die mittels eines solchen Werkzeugs erhalten werden können, könnten letztlich dazu beitragen, die erfolgreiche Entwicklung neuer therapeutischer Kandidaten voranzubringen.
Eine vorherige Arbeit unserer Arbeitsgruppe verwendete eine durch AstraZeneca entwickelte Benzimidazol-Struktur, um zu einem CB2R-selektiven “cis-on”-Affinitäts-Photoschalter via des Azo-Verlängerungsansatzes (“Azoextension”) zu gelangen.21a Für die vorliegende Arbeit haben wir dieses chemische Gerüst weiterverwendet, um funktionell selektive photoschaltbare Liganden als “Wirksamkeits-Schalter” (“efficacy switches”) für den CB2R zu entwickeln, indem ein photoschaltbarer Rest an der 2-Position des Benzimidazols eingeführt wurde. Viele GPCR Liganden,23 Enzym-Inhibitoren,24 antivirale25 oder antineoplatische26 Substanzen enthalten ein Benzimidazol-Grundgerüst, welches für seine hohe pharmakologische Bedeutung aufgrund seines breiten Spektrums biologischer Aktivitäten, die auf verschiedenen Substitutionsmustern der Kernstruktur basieren, bekannt ist.27 Es wurden mehrere Benzimidazol-Derivate als Medikament zugelassen.27b, 28 Hinsichtlich des CB2R wurden Benzimidazole verwendet, um potente selektive Agonisten und inverse Agonisten zu synthetisieren.23c, 29 Diese privilegierte Grundstruktur direkt im Kern photoschaltbar zu machen, könnte eine optische Kontrolle diverser Targets ermöglichen. Darüber hinaus haben Heteroarene als Photoschalter aufgrund ihrer hohen Steurbarkeit (“tunability”) Bedeutung erlangt.30 Während 2-Benzimidazol Azo-Arene bereits früher synthetisiert wurden,31 wurde ihr photoschaltbares Verhalten noch nicht untersucht. Mehrere photoschaltbare CBR-Liganden wurden kürzlich in der Literatur beschrieben. In unserer Gruppe wurde etwa “Photo-Rimonabant” synthetisiert, ein von Rimonabant-abgeleiteter photoschaltbarer CB1R Antagonist mit 15-fach höherer Affinität des cis-Photoisomers.21d Ein großer Fortschritt in Richtung optischer Kontrolle über den CB2R wurde 2021 durch die Arbeitsgruppe Carreira und durch Tao und seine Mitarbeiter im selben Jahr erzielt.21b, 21c Sarott et al. entwickelten photoschaltbare Derivate von HU308, mit denen optische Kontrolle über die Ca2+-Freisetzung in AtT-22(CB2) Zellen erzielt werden konnte, sowohl mit einer cis- als auch einer trans-aktiven Substanz.21b Des Weiteren verwendeten Hu et al. den CB2R Antagonisten AM10257, um mittels eines atypischen Azobenzol-Remodeling-Ansatzes einen photoschaltbaren CB2R Antagonisten mit einem 44-fach höherem IC50-Wert für die cis-Substanz zu erhalten.21c
Unsere photoschaltbaren 2-Benzimidazol-Azo-Arene weisen eine ausgeprägte funktionelle βArr2-Selektivität am CB2R auf. Substanz 10 d wurde als “Wirksamkeitschalter” mit Aktivierung des βArr2 Signalweges charakterisiert, während G-Protein Signalwege nicht aktiviert werden. Zusätzlich wies dieses neu erhaltene Benzimidazol-Gerüst im Vergleich zu regulären Azobenzolen überlegene photophysikalische Eigenschaften auf, denn es ermöglicht optische Kontrolle mit sichtbarem Licht. Unsere synthetisierten Substanzen wurden photocharakterisiert und in verschiedenen biologischen Assays untersucht, wodurch die pharmakologischen Unterschiede zwischen den verschiedenen Photoisomeren validiert werden konnten.
Ergebnisse und Diskussion
In der Literatur finden sich zwar viele heterogene aber vielversprechende Grundgerüste für CB2R Liganden, von denen einige verwendet wurden, um photoschaltbare Liganden zu synthetisieren. Basierend auf früheren Ergebnissen unserer Gruppe nutzten wir einen Liganden mit einer Benzimidazol-Struktur. Der potente, selektive CB2R Agonist 1 (Abbildung 1) wurde in unserer Gruppe als Vorlage verwendet, um einen photochromen CB2R “Affinitätsschalter” zu erhalten, in dem ein Azobenzol eingebaut wurde.21a Struktur-Wirkungsbeziehungen (“structure-affinity relationships”, SARs), die von AstraZeneca durchgeführt worden waren, heben das Benzolring-Substitutionsmuster als wichtige, sensitive Eigenschaft hervor, wo kleine Änderungen an der Substitution die Wirksamkeit in vitro beeinflussen können. Durch die einfache Einführung einer Fixierung der p-Ethoxy-Gruppe wurde die Wirksamkeit invertiert und Substanz 2 erwies sich als ein potenter, selektiver CB2R inverser Agonist.23c, 29
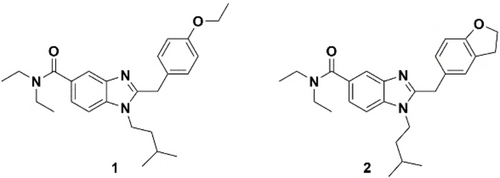
Benzimidazol-basierte hCB2R Leitstrukturen.
Durch die Möglichkeit, die agonistische Wirkung an dieser empfindlichen Position zu beeinflussen, wurde dieses Gerüst für die Synthese eines „Wirksamkeitsschalters“ ausgewählt. Um eine licht-abhängige räumliche Kontrolle über diese sensitive Position zu erlangen, wurde eine Azo-Bindung in dieses Gerüst eingeführt, um das Benzimidazol mit dem Benzolring zu verbinden, wodurch Benzimidazol Azo-Arene entstehen (Abbildung 2).
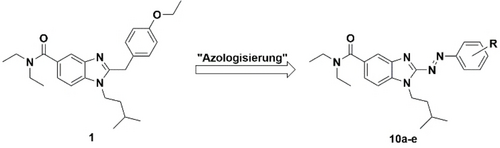
Nicht-klassischer Azologisierungsansatz, um 2-Benzimidazol Azo-Arene zu erhalten.
Abgeleitet von Substanz 1 (Schema 1) wurden fünf Benzimidazol Azo-Arene (10 a–e) synthetisiert. Durch das Ersetzen der Methylen-Einheit durch eine Azo-Bindung werden die molekulare Struktur sowie die elektronischen Eigenschaften verändert. Der Benzyl-Rest an der 2-Position des Benzimidazols wurde verlängert und könnte daher nicht mehr in derselben räumlichen Orientierung liegen wie bei der Ausgangssubstanz 1. Aufgrund dieser strukturellen Änderungen war nicht bekannt, ob eine para-Substitution am Benzol dieselbe räumliche Orientierung aufweisen würde wie bei Ausgangssubstanz 1. Daher wurde der Ethoxy-Ether zunächst sowohl in der meta-Position (10 a) als auch in para-Position (10 b) angefügt. Nachdem ein größerer cis/trans-Unterschied bezüglich CB2R Affinität für die para-Substitution beobachtet worden war, was sehr wahrscheinlich durch räumliche Beeinflussung der sensitiven Position auftrat, wurde das Substitutionsmuster weiterer Derivate entsprechend ausgewählt. Als nächstes wurde eine Methoxy-Gruppe als ein kleinerer Substituent eingeführt (10 c), um eine mögliche Verlängerung der Struktur durch die Einführung eines photoschaltbaren Rests zu kompensieren. Anstelle des phenolischen Ethyl-Ethers wurde als ein Konstitutionsisomer ein Methoxymethyl-Substituent angefügt (10 d) mit einer anderen Position des Sauerstoffs innerhalb der Alkyl-Kette. Damit sollte untersucht werden, ob die Einführung einer Azo-Bindung eine andere Sauerstoff-Position für Benzimidazol-Azo-Arene benötigt und ob die Sauerstoff-Position oder elektronische Effekte wichtig für die Interaktion mit dem Rezeptor sind und dadurch die Affinität/Wirksamkeit beeinflusst werden kann – mit einem potentiell noch größer ausgeprägten cis/trans-Unterschied. Darüber hinaus wurde eine Isopropyl Substitution (10 e) gewählt, um zu untersuchen, ob eine Interaktion primär auf sterischen Effekten basiert und um die potentielle Bedeutung des Sauerstoffs herauszustellen, welche bei der Aufstellung der SARs für die Ausgangssubstanzen 1 und 2 beibehalten wurde. Die Zielstrukturen wurden hinsichtlich ihrer Affinität in Radioligand-Bindungsstudien getestet und wurden weiterhin hinsichtlich ihrer Fähigkeit, G Protein (Gα16 and Gαi) sowie βΑrr2 Antworten auszulösen, beurteilt.
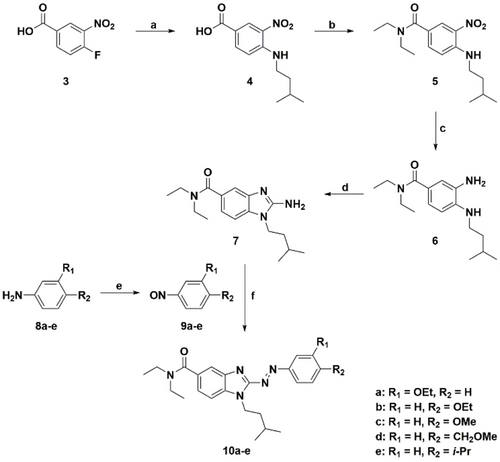
Synthese von 2-Benzimidazol Azo-Arenen. Reagenzien und Reaktionsbedingungen: (a) 3-Methylbutylamin, MeOH, RT, 2 h; (b) i. HBTU, N,N-Dimethylformamid (DMF), RT, 30 min; ii. NHEt2, NEt3, DMF, RT, 8 h; (c) H2, Pd/C, MeOH, RT, 21 h; (d) BrCN, rt, über Nacht; (e) Oxon®, Dichloromethan/Wasser, RT, 2–16 h; (f) Toluol/NaOH (40 %, aq.) 1 : 1 (2 mL/mmol), 80 °C, 2–4 h.
Die Benzimidazol Azo-Arene wurden aus einem 2-Aminobenzimidazol-Derivat und den entsprechenden Nitroso-Verbindungen in einer modifizierten Baeyer-Mills-Reaktion synthetisiert (Schema 1). Die 2-Aminobenzimidazol-Vorstufe 7 wurde aus der kommerziell erhältlichen 4-Fluor-3-Nitrobenzoesäure (3) synthetisiert. Eine nukleophile aromatische Substitution mit Isopentylamin lieferte in quantitativer Ausbeute Substanz 4. Das Amid 5 wurde unter Verwendung von Diethylamin und HBTU gebildet. Die Reduktion der Nitro-Gruppe wurde mittels Wasserstoff und Pd/C durchgeführt, um Anilin 6 in quantitativer Ausbeute zu erhalten. Die Synthese von Substanz 6 wurde bereits zuvor von unserer Gruppe unter anderen Reaktionsbedingungen beschrieben,32 aber die Ausbeute konnte durch die gängigere Palladium-Reduktion verbessert werden. Das 2-Benzimidazolamin 7 wurde unter Verwendung des ungiftigen 1,3-bis(tert-Butoxycarbonyl)-2-methyl-2-thio-pseudoharnstoffs – wie bereits in der Literatur beschrieben – synthetisiert.25 Da dieser Ansatz nur eine geringe Ausbeute an Boc-Aminobenzimidazol sowie der Boc-ungeschützten Substanz 7 lieferte, wurde der Ringschluss in hoher Ausbeute (>90 %) mit Bromcyan erreicht. Die entsprechenden Nitroso-Verbindungen 9 a–e wurden durch partielle Oxidation der entsprechenden Aniline mit Oxon® erhalten. Zum Schluss wurde eine modifizierte Baeyer-Mills Reaktion unter basischen Bedingungen durchgeführt, indem eine 1 : 1 Mischung von 40 % NaOH und Toluol verwendet wurde, eine vielseitige von Fuchter und Mitarbeitern beschriebene Methode zur Synthese von Arylazopyrazolen, die nachweislich für ein breites Spektrum an Azo-Heteroarenen funktioniert.33
Um das neue photoschaltbare Gerüst hinsichtlich seiner photophysikalischen Eigenschaften zu charakterisieren, wurden die Substanzen 10 a–e mittels UV/Vis Spektroskopie sowohl in einer 30 μM DMSO-Lösung als auch in Tris-Puffer (pH=7.4) untersucht, um reversible Photoisomerisierung zu bestätigen und eine mögliche „Photo-Fatigue“ auszuschließen (Hintergrundinformationen Abbildung S1–S5). Licht unterschiedlicher Wellenlängen zwischen 365 nm und 590 nm wurde verwendet, um die idealen Schaltwellenlängen zu bestimmen. Alle 2-Benzimidazol Azo-Arene wiesen die höchste Photokonversion in die cis-Konfiguration mit sichtbarem Licht (λ=400 nm) auf, sie also ein “rot-verschobenes” Verhalten im Vergleich zu regulären Azobenzolen zeigen, die die höchste cis-Konversion nach Bestrahlung mit UV Licht (λ=365 nm) aufweisen.34 Photoisomerisierung zurück in die trans-Photoisomere wurde entweder durch grünes (λ=530 nm, 10 a und 10 e) oder sogar orange-farbenes Licht (λ=590 nm, 10 b–d) erreicht, was durch den langen Wellenlängen-Absorptionsschweif der entsprechenden cis-Photoisomere möglich wurde.
Das Absorptionsspektrum von Verbindung 10 d ist in Abbildung 3 gezeigt. Für reguläre Azobenzole besteht das Absorptionsspektrum aus einer hohen Absorptionsbande um 325 nm was einem π→π* Übergang entspricht und einer schwächeren Absorptionsbande bei 430 nm was einem n→π* Übergang entspricht. Dies wurde entsprechend auch für Arylazo-Imidazole gezeigt, mit einem leicht verschobenen Absorptionsmaximum bei 361–375 nm (π→π*) und um 450 nm (n→π*).35 Für 2-Benzimidazol Azo-Arene wurden diese Absorptionsmaxima sogar noch weiter rot-verschoben zu 383–402 nm (π→π*) und etwa 500 nm (n→π*), abhängig von der Substitution am Benzol-Ring. Eine abwechselnde Bestrahlung mit violettem (λ=400 nm) und orange-farbenem (λ=590 nm) oder grünem (λ=530 nm) Licht führte zu einer reversiblen Photokonversion zwischen den entsprechenden cis- und trans-angereicherten Stadien aller Substanzen. Das photochrome Verhalten war auch nach mehrfach wechselnden Zyklen stabil, daher trat keine Photo-Fatigue auf (bzgl. Substanz 10 d, siehe Abbildung 4).
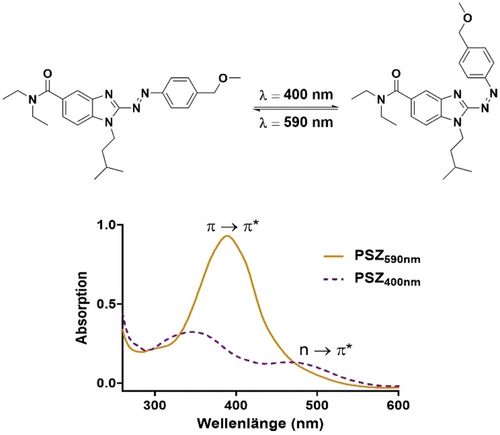
Repräsentative Photoisomerisierung von Verbindung 10 d (30 μM in wässrigem Tris-Puffer, pH=7.4) und ihr UV-Absorptionsspektrum nach Bestrahlung mit violettem Licht (λ=400 nm, violette gestrichelte Linie) bzw. orange-farbenem Licht (λ=590 nm, durchgezogene orange-farbene Linie).
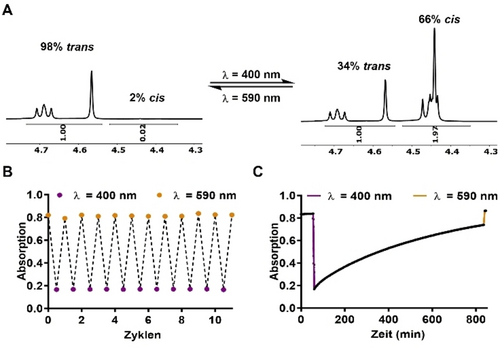
Photophysikalische Charakterisierung von Verbindung 10 d. (A) Bestimmung der cis/trans Verhältnisse mittels Signalverschiebung analysiert in CD3OD durch 1H NMR-Spektroskopie nach Bestrahlung mit orangem Licht (λ=590 nm, links) und purpurnem Licht (λ=400 nm, rechts). Die 1H-Signale der Aryl-CH2−O−CH3 und der N−CH2 (isopentyl) Protonen wurden bei Photoisomerisierung Hochfeld-verschoben und für die Berechnung der photostationären Zustände (PSZ) verwandt. (B) Schaltzyklen von Verbindung 10 d (30 μM in wässrigem Tris-Puffer, pH=7.4) ohne nennenswerte Photofatigue. (C) Messung der thermischen Stabilität von 30 μM cis-10 d nach Bestrahlung bei 400 nm in Tris-Puffer/10 % DMSO (pH=7.4, RT); gemessen nach 13 h und zurückgeschaltet in das trans-Photoisomer bei 590 nm.
Die thermische Stabilität von 2-Benzimidazol Azo-Arenen wurde in DMSO und in wässrigem Tris-Puffer (pH=7.4, mit 10 % DMSO) gemessen. Diese unterschied sich stark hinsichtlich der verschiedenen Substituenten und deren Position am Benzol-Ring (Table 1). Für elektronenziehende Substituenten in para-Position wurde bereits gezeigt, dass diese die thermische cis→trans Relaxationszeit bei Azobenzolen verringern.36 Bei Benzimidazol Azo-Arenen führte die Einführung des p-Ethoxy-Ethers (10 b) zu einer kürzeren Halbwertszeit als für das meta-Derivat (10 a). Diese Korrelation zeigte sich konsistent sowohl in DMSO als auch wässriger Puffer-Lösung, wobei die Halbwertszeiten in Puffer deutlich kürzer waren. Die Verkürzung des Substituenten zu einem p-Methoxy-Ether (10 c) verringerte die Halbwertszeit in DMSO weiter. Dies steht in Einklang mit der Beobachtung, dass die thermische Relaxation substituierter Azobenzole Lösemittel-abhängig ist und die Halbwertszeiten entsprechend kürzer werden, insbesondere in wässrigen physiologischen Lösungen aufgrund von Wasserstoffbrückenbindungen.34 Im Gegensatz dazu dauerte die thermische Relaxation bei 2-Benzimidazol Azo-Aren 10 d länger in wässriger Puffer-Lösung als in DMSO. Insgesamt zeigten unsere Benzimidazol Azo-Arene, auch im Vergleich zu anderen photoschaltbaren Azo-Hetero-Aren-Strukturen, exzellente thermische Halbwertszeiten sowohl in DMSO als auch in Puffer.37
Substanz |
λcis % trans-Isomer[a] |
λtrans % cis- Isomer[a] |
t1/2 [min] in DMSO[b] |
t1/2 [min] in Puffer[b] |
|---|---|---|---|---|
10 a |
83 |
70 |
345 |
251 |
10 b |
99 |
60 |
126 |
1.8 |
10 c |
96 |
68 |
81.8 |
4.6 |
10 d |
98 |
67 |
245 |
346 |
10 e |
89 |
78 |
200 |
170 |
- [a] Höchste erhaltbare Menge an cis- oder trans-Photoisomeren nach Bestrahlung mit der jeweiligen optimalen Wellenlänge zur Photoisomerisierung. PSZ wurden nach Bestrahlung bei der entsprechenden Wellenlänge mittels 1H NMR -Spektroskopie oder HPLC-MS (in MeOH) an den entsprechenden isobestischen Punkten gemessen. Die Verhältnisse waren unabhängig von der Methode oder der Konzentration. [b] 400 nm Licht wurde zur Anregung zu den cis-Photoisomeren verwendet; Absorption der jeweiligen 30 μM Lösung wurde für mindestens 8 h gemessen (Daten in den Hintergrundinformationen).
Photostationäre Zustände („photostationary states“, PSZ), d. h. das Verhältnis der cis- zu trans-Photoisomeren, welches nach einer Bestrahlung mit einer bestimmten Wellenlänge entsteht, wurde mittels 1H NMR-Spektroskopie gemessen und mittels HPLC-MS bestätigt (siehe Tabelle 1). Die trans-Photoisomere entstehen in hoher, teilweise sogar in nahezu quantitativer Ausbeute nach Bestrahlung mit orange-farbenem (λ=590 nm) oder grünem (λ=530 nm) Licht. Nach Bestrahlung mit violettem Licht (λ=400 nm) bleibt jedoch ein Teil der jeweiligen Verbindung in seiner trans-Form. Derartige PSZ sind nicht ungewöhnlich für mit sichtbarem Licht schaltbare Azoheteroarene.38 Diese unvollständige Schaltung könnte zu einer Unterschätzung der pharmakologischen Wirksamkeit führen, welche durch das cis-Photoisomer der entsprechenden Verbindung verursacht wird. Allerdings verhalten sich generell biologische Systeme nicht-linear, so dass ausgeprägte biologische Effekte auch unter schlecht definierten cis/trans Verhältnissen entstehen können.34
Alle synthetisierten Substanzen erwiesen sich bei der Untersuchung der photophysikalischen Eigenschaften als photoschaltbar, sodass untersucht wurde, ob diese Veränderungen der Struktur die Affinität zum CB2R oder die Selektivität gegenüber CB1R beeinflussen. Die Affinität der entsprechenden cis- und trans-angereicherten Stadien wurde in Radioligand-Bindungsstudien untersucht (siehe Tabelle 2, Hintergrundinformationen Abbildung S6). Da dieser Assay bei Raumtemperatur und unter Lichtausschluss durchgeführt werden kann, kann eine Isomerisierung der verschiedenen Photoisomeren aufgrund von Lichtexposition effektiv verhindert werden. Andererseits ist auch eine kontinuierliche Bestrahlung der Platten während der Inkubation möglich und bei Substanzen mit einer kurzen Halbwertszeit sogar notwendig. Auf diese Weise können falsch negative oder falsch positive Ergebnisse aufgrund einer Isomerisierung zwischen den Photoisomeren während der 3-stündigen Inkubationszeit verhindert werden. Die entsprechenden cis-Photoisomere der Testsubstanzen benötigen entweder kontinuierliche oder mindestens alle 20 min eine Bestrahlung mit violettem Licht (λ=400 nm), um eine Rück-Isomerisierung zu verhindern, damit sichergestellt werden kann, dass das cis/trans-Verhältnis während der Messung auf dem vorab bestimmten Niveau bleibt. Im Vorfeld wurde bestätigt, dass die Bestrahlung die Bindungsaffinität der Referenzsubstanz 1 nicht beeinflusst, für die ein Ki von 27 nM bestimmt wurde. Alle untersuchten Substanzen wiesen Affinität gegenüber CB2R im mikromolaren Bereich auf (Tabelle 2). Strukturelle Veränderungen, um ein photoschaltbares Molekül zu erhalten (d. h. Einführung einer Azo-Verbindung in potentiell sensitive Positionen) können zu einem gewissen Affinitätsverlust führen,39 welcher allerdings akzeptiert werden kann, wenn die Verbindung reversible Photokontrolle an einem bestimmten Rezeptor erzielt.18a Für die meta-Substitution am Benzolring des Benzimidazol-Azo-Aren-Gerüsts (10 a) wurde kein Unterschied zwischen den Bindungsaffinitäten der beiden Photoisomere beobachtet. Die cis-Photoisomere der para-substituierten Benzimidazol-Azo-Arene wiesen höhere Affinitäten gegenüber CB2R (“cis-on”-Affinität) auf, wobei bei 10 d der größte Unterschied zwischen den beiden Photoisomeren hinsichtlich dieses pharmakologischen Schlüsselparameters zu sehen war. Das cis-angereicherte Stadium von 10 d, welches durch Bestrahlung mit violettem Licht entsteht, zeigte eine 6.5-fach höhere Affinität in seiner thermodynamisch stabileren trans-Form (Abbildung 5A). Wird berücksichtigt, dass im beschriebenen cis-angereicherten Stadium von 10 d noch etwa 34 % der trans-Substanz enthalten sind, wird der tatsächliche Unterschied in der Affinität wohl noch höher sein.
Verbindung/ Photoisomer |
rCB1 Ki [μM] (−pIC50±SEM) oder [3H]CP55940 Verdrängung bei 1 μM |
CB2 trans/ cis Verhältnis |
hCB2 Ki [μM] (−pIC50±SEM) |
|
|---|---|---|---|---|
1 |
<10 % |
– |
0.027 (7.56±0.056) |
|
Rimonabant |
0.056 (7.16±0.056) |
– |
– |
|
CP55940 |
0.0088 (8.02±0.054) |
|
0.013 (7.86±0.071) |
|
10 a |
cis |
<10 % |
1.3 |
9.1 (5.02±0.060) |
trans |
<10 % |
12 (4.89±0.087) |
||
10 b |
cis |
<10 % |
3.0 |
5.0 (5.28±0.066) |
trans |
<10 % |
15 (4.80±0.065) |
||
10 c |
cis |
<10 % |
1.9 |
4.3 (5.35±0.055) |
trans |
<10 % |
8.3 (5.06±0.067) |
||
10 d |
cis |
10 % |
6.5 |
1.3 (5.86±0.033) |
trans |
<10 % |
8.4 (5.05±0.064) |
||
10 e |
cis |
<10 % |
2.7 |
1.6 (5.79±0.060) |
trans |
<10 % |
4.3 (5.35±0.058) |
||
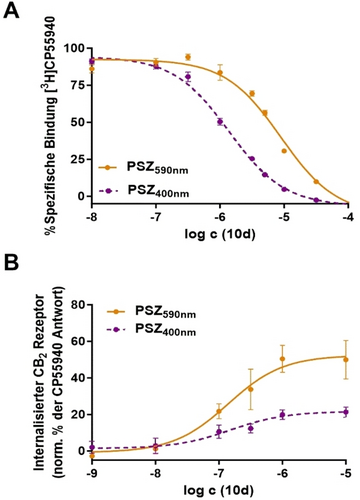
Pharmakologische Untersuchungen von Verbindung 10 d. Datenpunkte und Fehlerbalken repräsentieren die Mittelwerte aus drei unabhängigen Experimenten ± Standardabweichung („standard error of the mean“, SEM). Photoisomere: cis-10 d (violett, gestrichelte Kurve) und trans-10 d (orange-farbene, durchgezogene Kurve). (A) Radioligand-Bindungs-Assay mit hCB2R HEK293 Membranen. (B) Ligand-induzierte Internalisierung von FLAG-Epitop-markiertem hCB2R in HEK293 Zellen.
Um die G-Protein-abhängige Wirksamkeit zu untersuchen, wurden die 2-Benzimidazol Azo-Arene in einem hCB2R Gα16-gekoppelten Fluoreszenz-basierten Kalzium-Mobilisierungs-Assay getestet. Stabil transfizierte Chinesische Hamster-Ovarien-K1-Zellen (CHO) mit hCB2R-Überexpression wurden verwandt, um mit Fluo-4AM die intrazelluläre Kalzium-Antwort zu messen. Die Verbindungen 10 a–e wurden in beiden Photoisomer-Formen vermessen. Da die Verbindungen in Puffer verlässlich isomerisieren, wurden die in Puffer verdünnten Substanzen direkt vor dem Experiment mit der entsprechenden Wellenlänge bestrahlt. Die Referenzverbindung 1 und CP55940 (EC50=21.4 nM) wurden als Kontrollen für CB2R Agonismus verwandt (Hintergrundinformationen Abbildung S7). Auch wenn dieser Assay eine geringere Sensitivität für Substanzen im mikromolaren Bereich hat, konnte eine agonistische Antwort relativ einfach gemessen werden. Die Referenz-Substanz 1 verhielt sich als Agonist am CB2R mit nanomolarer Wirksamkeit (EC50=54.0 nM). Zu unserer Überraschung zeigte keine der synthetisierten 2-Benzimidazol Azo-Aren-Derivate eine Wirksamkeit hinsichtlich Ca2+ Mobilisierung in einem der beiden photoisomeren Stadien bei Konzentrationen von 10 nM bis zu 30 μM (Hintergrundinformationen Abbildung S7). Nur bei cis-10 b wurde eine leicht agonistische Antwort gemessen mit maximaler Aktivierung (Emax) von 15 %, während Verbindungen 10 c und 10 e sich als inverse Agonisten zu verhalten scheinen.
Um die Eigenschaften von Verbindungen 10 a–e weitergehend hinsichtlich der Fähigkeit zu untersuchen, einen nicht-chimären G-Protein-Signalweg zu aktivieren, wurde ein NanoBiT® Luciferase-Assay durchgeführt, der die mini-Gαi Rekrutierung am hCB2R misst. Zusätzlich wurde die βarr2 Rekrutierung mit einem ähnlichen NanoBiT® Assay bestimmt. Basierend auf drei unabhängigen Versuchen zeigten Verbindungen 10 a, 10 b und 10 d (im nicht-bestrahlten Stadium) keine Signale bei der mini-Gαi Interaktion bei Konzentrationen bis zu 1 μM, wobei ein (begrenztes) Potential zur Interaktion von βarr2 mit CB2R bei Verbindungen 10 a, 10 b und 10 d gesehen wurde. Bei allen drei Verbindungen führten höhere Konzentrationen (100 μM, 10 μM) zu einem substanziellen Anstieg des Lumineszenz-Signals in beiden Assays (für CB2 mini-Gαi, siehe Hintergrundinformationen Abbildung S8). Um zu beurteilen, ob dieses Phänomen hCB2R-abhängig ist, wurden hohe Konzentrationen der Substanzen in einem orthogonalen Assay unter Verwendung von μ Opioid (MOR)-βarr2 NanoBiT® vermessen. Ähnliche “Inaktivierungs”-Profile wurden an MOR beobachtet, was bedeutet, dass die deutliche Abnahme der Lumineszenz nicht CB2R spezifisch ist (Daten nicht gezeigt). Eine plausible Hypothese für dieses Phänomen hängt mit den Farbstoffeigenschaften der getesteten Verbindungen zusammen. Die unverdünnten Ausgangslösungen der höchsten Konzentrationen der Substanzen 10 a, 10 b and 10 d weisen eine helle Orangefärbung auf. Berücksichtigt man das Absorptionsspektrum (Hintergrundinformationen Abbildung S1–S5), führen höhere Konzentrationen der Substanzen zur Absorption eines Teils der Lumineszenz, die durch das Nanoluziferase-Enzym ausgesendet wird (Emissions-Wellenlänge 460 nm).40 Diese intrinsische Limitierung des Nanoluziferase-Enzyms beeinträchtigt die Auswertung höherer Konzentrationen dieser Verbindungen in den Assays.
Beim Vergleich von mini-Gαi und βarr2, konnte aufgrund der zuvor genannten Limitationen des Assays sowie aufgrund der fehlenden Aktivität im mini-Gαi Signalweg kein Selektivitiätsfaktor berechnet werden. Dennoch weisen die Daten in Abbildung S9 (Hintergrundinformationen) darauf hin, dass eine bevorzugte Interaktion mit βarr2 vorhanden ist, da niedrigere Konzentrationen von 10 a und 10 b immer noch zu einer Rekrutierung von βarr2 führen, wohingegen sie sich dieselben Konzentrationen im mini-Gαi Rekrutierungs-Assay als inaktiv erwiesen.
Da 10 a, 10 b und 10 d ein gewisses βArr2 Rekrutierungs-Potential besitzen, wurden beide photoisomeren Zustände auch bei verschiedenen Konzentrationen im hCB2-βArr2 Assay getestet. Die Ausgangslösungen wurden vor dem Versuch mit den entsprechenden Wellenlängen bestrahlt. Für beide Photoisomere diente CP55940 als Referenzstandard. Alle drei Verbindungen erwiesen sich als schwach aktiv im hCB2-βArr2 Bioassay mit vernachlässigbaren Aktivitätsunterschieden zwischen den cis- and trans-Photoisomeren. Insgesamt besaß 10 b die höchste Aktivität im hCB2R-βarr2 Rekrutierungs-Assay mit einer maximalen Aktivierung von 23 % (cis) und 18 % (trans) bei der höchsten getesteten Konzentration (500 nM) bezogen auf CP55940,, gefolgt von 10 a mit einer relativen Wirksamkeit von 15 % für beide Photoisomere. Verbindung 10 d wies mit einer Wirksamkeit von <5 % die geringste Aktivität für das cis-Photoisomer und 6 % für das trans-Photoisomer auf, bezogen auf Emax von CP55940, welches gleich 100 % gesetzt wurde (Hintergrundinformationen Abbildung S10). Es kann erwartet werden, dass der Einsatz höherer Konzentrationen (1 μM und höher) zu einer größeren Wirksamkeit für alle drei Substanzen führt. Dennoch wurden aufgrund der intrinsischen Limitationen hohe Konzentrationen nicht getestet und sigmoidale Dosis-Wirkungskurven konnten nicht vollständig aufgezeichnet werden. In ähnlicher Weise konnten die Aktivitätsunterschiede beim Vergleich der Photoisomere sowie die Wirksamkeitsstärke (EC50) nicht akkurat bewertet werden, da das Plateau der maximalen Aktivierung nicht erreicht wird und daher keine Aussage zu potenziellen cis/trans-Unterschieden gemacht werden konnte.
Da eine gewisse βArr2 Rekrutierung bei den Verbindungen beobachtet werden konnte, wurde die CB2R-Aktivierung daraufhin mittels konfokaler Mikroskopie untersucht, um die Rezeptor-Internalisierung zu messen, welche funktional mit dem βarr2 Signalweg zusammenhängt, da gezeigt wurde, dass durch Unterdrückung der βArr2 Expression die CB2R-Internalisierung inhibiert wird.41 Während eine βArr-Interaktion bei einigen GPCRs ohne funktionale G-Proteine gezeigt wurde, resultierte dies nicht in einer G-Protein unabhängigen Signaltransduktion und daher sollte man entweder die Oberflächenverteilung von GPCRs via eines endozytotischen Signalweges kontrollieren oder einen Signalweg aus dem Inneren der Zelle miteinbeziehen.42
Verbindung 10 d, welche die größte cis/trans-Differenz hinsichtlich der CB2R Affinität aufwies, wurde mit konfokaler Mikroskopie an humanen embryonalen Nierenzellen (HEK) 293 Zellen untersucht, welche stabil einen FLAG-Epitop-markierten hCB2R (F-hCB2R) exprimieren und mit einem AlexaFluorTM-568 konjugiertem antiFLAG-M1-Antikörper detektiert werden. Diese Daten zeigen, dass die Substanz die Fähigkeit besitzt, eine CB2R Internalisierung zu induzieren, wobei sich trans-10 d als effektiver erwies als ihr cis-Photoisomer (siehe Abbildung S14, Hintergrundinformationen), was überraschend ist, da cis-10 d eine höhere CB2R-Affinität besitzt. Aufgrund der gegebenen konstitutiven Rezeptoraktivität und -internalisierung (siehe unbehandelte Probe in Abbildung S14, Hintergrundinformationen), war allerdings die Quantifizierung schwierig.
Um diese Einschränkungen zu umgehen und um weitergehend zu beurteilen, ob eine bevorzugte βArr2 Rekrutierung tatsächlich auch zu einer βArr2 Selektivität führt, wurden die Substanzen in einem Durchflusszytometrie-basierten CB2R Internalisierungs-Assay untersucht, was sich bereits zuvor als sehr hilfreich für eine genaue Quantifizierung der Internalisierung erwiesen hatte.43 Die Wirksamkeit der 2-Benzimidazol Azo-Arene wurde hinsichtlich ihres Effekts auf die βArr2-vermittelte Endozytose von F-hCB2R in stabil exprimierenden HEK293 Zellen untersucht, mit einem Fluoreszenz-konjugiertem antiFlag-M1 Antikörper detektiert und mittels Durchflusszytometrie gemessen.43b Agonistische Wirkung wurde in Prozent der CP55940-verursachten Internalisierung angegeben. Verdünnungen wurden in DMSO vorgenommen und mit den entsprechenden Wellenlängen vor Zugabe in die Vertiefungen (“wells”) bestrahlt. Um das cis-Photoisomer zu untersuchen, wurde die Bestrahlung der 12-Well-Platten zusätzlich drei Mal während der Inkubationszeit von 45 min bei 37 °C durchgeführt, um die Verbindungen in ihrem cis-angereichertem Stadium zu halten. Die Ausgangssubstanz 1 erwies sich hinsichtlich der Endozytose als voller Agonist mit nanomolarer Wirksamkeit (EC50 (CB2R)=2.7 nM), wobei diese nicht durch Bestrahlung beeinträchtigt wurde. Alle synthetisierten Verbindungen wurden initial hinsichtlich der Wirkung auf die CB2R Internalisierung bei einer 1 μM Konzentration getestet (Hintergrundinformationen Abbildung S11). Die potentesten Substanzen 10 a, 10 b und 10 d wurden für die Erstellung der Dosis-Wirkungs-Kurven der beiden Photoisomere ausgewählt. Für das meta-substituierte 2-Benzimidazol Azo-Aren 10 a wurde kein cis/trans-Unterschied hinsichtlich der Wirkung auf die CB2R Endozytose festgestellt, was im Einklang mit den Ergebnissen der Radioligand-Bindungsstudien steht. Beide Photoisomere wirken als partielle Agonisten (Emax=43–46 %) mit einem ähnlichen EC50-Wert im sub-mikromolaren Bereich (EC50 (CB2R)=300 nM, Hintergrundinformationen Abbildung S12B). Wenn die Ethoxy-Funktion von der meta- zur para-Position (10 b) verschoben wird, wird das cis-Photoisomer ein potenterer partieller Agonist (EC50 (CB2R)=25.1 nM; Emax=41 %) als sein korrespondierendes trans-Photoisomer (EC50 (CB2R)=49.8 nM; Emax=32 %; Hintergrundinformationen Abbildung S12C). Dies weist darauf hin, dass eine para-Substitution, wie es auch bei der Ausgangssubstanz 1 der Fall war, immer noch günstig am CB2R ist. Verbindung 10 d verhielt sich als partieller Agonist am CB2R in seinem trans-Photoisomer, mit einem sub-mikromolarem EC50-Wert von 139 nM (Emax=51 %). Auch wenn das cis-Photoisomer von 10 d eine 6.5-fach höhere Affinität zu CB2R hat, erreichte die gemessene Wirksamkeit nur einen Emax von 22 %, mit einem ähnlichen EC50=153 nM wie bei seinem trans-Photoisomer (Figure 5B). Eine plausible Erklärung für dieses Phänomen könnte die beobachtete unvollständige Photoisomerisation zum cis-Photoisomer sein, welches immer noch 34 % des trans-Photoisomers im cis-angereicherten Stadium enthält. Der Unterschied im Emax-Wert steht in Übereinstimmung mit den Daten der konfokalen Mikroskopie und bestätigt, dass trans-10 d bei Betrachtung der Internalisierung ein wirkungsvollerer Agonist ist. Wir vermuten, dass eine p-Ethoxy-Substitution (10 b) des Benzimidazol-Azo-Aren-Gerüsts immer noch die richtige Länge und räumliche Orientierung hat, um am CB2R (mit schwacher “cis-on” Wirksamkeit) zu wirken. Während ein Teil der Affinität durch eine Veränderung der Sauerstoff-Position bei seinem Konstitutionsisomer 10 d verloren geht, führt dies dennoch zu verbesserten photophysikalischen und photopharmakologischen Eigenschaften, die sich unter den Untersuchungsbedingungen als geeigneter erwiesen. Die vielversprechendste Substanz 10 d zeigt dadurch sehr interessante pharmakologische Eigenschaften, daß sie ein “cis-on”-Affinitätsschalter, aber ein “trans-on”-Wirksamkeitsschalter ist (Abbildung 5). Daher ist die Bindungsaffinität von Substanz 10 d in ihrer inaktiven Form (PSS400nm) am CB2R höher und verringert sich unter Bestrahlung mit orangefarbenem Licht (PSS590nm), was von einer Freischaltung der Aktivierung des βArr2 Signalwegs begleitet zu sein scheint. Da dieser Assay nicht durch eine Wechselwirkung der Eigenabsorption der Verbindung mit dem Auslesen des fluoreszenz-markierten Antikörpers (Exzitation/Emission 650/665 nm) eingeschränkt wird, konnten vollständige Dosis-Wirkungs-Kurven gemessen werden. Da zudem dieser Assay sensitiver als der Radioligand-Bindungsassay zu sein scheint, wurden alle Substanzen nochmals hinsichtlich CB1R Selektivität getestet. Bei einer Konzentration von 1 μM wurde für keines der Photoisomere eine agonistische Wirkung hinsichtlich der Menge an internalisiertem CB1R beobachtet, was die exzellente Selektivität der synthetisierten 2-Benzimidazol Azo-Arene beweist.
Um eine βArr-Abhängigkeit des Experiments für Verbindung 10 d zu bestätigen, setzten wir Arrestin 2/3 siRNA ein, um die βArr-Expression auszuschalten und bestimmten das Ausmaß der anschließenden Internalisierung. Mit früheren Ergebnissen übereinstimmend44 konnten wir zeigen, dass eine CB2R Internalisierung als Reaktion auf CP55940-Inkubation Arrestin-Proteine benötigt, aber unabhängig von einer Gi/o Protein-Aktivierung ist.43a Wir konnten bestätigen, dass dies auch der Fall für CB2R Internalisierung als Reaktion auf unsere Verbindung ist, da signifikant weniger CB2R im Vergleich zur Kontrolle nach Stimulation mit trans-10 d in βArr-Knockdownzellen internalisiert wurde (Abbildung S13, Hintergrundinformationen). Daher konnte bei unserer Auswahl chemisch sehr ähnlicher Verbindungen mit ähnlichen Affinitäten am CB2R eine funktionelle βArr2-Selektivität für Substanz 10 d durch eine präferierte Selektivität gegenüber des βArr2 Endozytoseweges bestätigt werden.
Die Bindung von βArr wurde lange nur mit Rezeptor-Desensibilisierung assoziiert, es wurde aber auch festgestellt, dass G-Protein-abhängige nachgeschaltete Signalwege, wie die extrazellulär Signal-regulierte Kinase (ERK)-Aktivierung moduliert werden.11a, 14, 42 Um die Wirkung der Referenzsubstanz CP55940 und unserer Verbindung 10 d für beide cis- und trans-Photoisomere zu untersuchen, führten wir Western Blot Untersuchungen durch, um die Phosphorylierung von ERK1/2 am TEY-Motiv zu beurteilen.45 Die Phosphorylierung des TEY-Motivs ist für die enzymatische Aktivität dieser Kinasen essentiell. Nach einer 8-minütigen Stimulation beobachteten wir einen konzentrations-abhängigen Anstieg der ERK1/2 Aktivierung für beide Photoisomere der Substanz 10 d. Zusätzlich war zu sehen, dass trans-10 d die ERK1/2 Phosphorylierung in größerem Ausmaß induzierte als ihr cis-Photoisomer, wie in Abbildung 6 gezeigt. Auch dieses Ergebnis bestätigt, dass Substanz 10 d ein “trans-on”-Wirksamkeitsverhalten am CB2R besitzt, was sogar in einem nachgeschalteten Signalweg-Assay detektierbar ist.
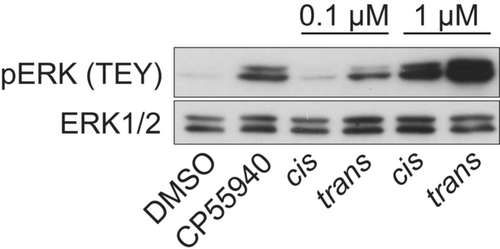
Detektion der ERK-Phosphorylierung durch Western Blot Analyse. Die Aktivierung von ERK1/2 durch CB2R Liganden wurde untersucht durch die Messung der ERK1/2 Phosphorylierung (pERK1/2) am TEY-Motiv als Reaktion auf Inkubation mit CP55940 (10 μM) oder den cis- bzw. trans-Photoisomeren der Verbindung 10 d (0.1 μM und 1.0 μM) über 8 min. Gesamtes ERK1/2 wurde als Kontrolle verwendet.
Zusammenfassung
Wir berichten in diesem Artikel von dem ersten mit sichtbarem Licht schaltbaren βArr2 funktionell selektiven CB2R Agonisten. Mittels eines nicht-klassischen Azologisierungs-Ansatzes aus einem selektiven CB2R Liganden ohne funktionelle Selektivität, welcher die “priviligierte” Benzimidazol-Struktur aufweist, entwickelten und photocharakterisierten wir neuartige photoschaltbare Gerüste von 2-Benzimidazol Azo-Arenen und testeten diese Struktur in einem Set von pharmakologischen Assays. Modifikationen der Substitution am Benzolring haben einen großen Einfluss auf das Verhalten dieser Klasse neuer Photoschalter, was besonders an den stark unterschiedlichen, aber ausreichend langen thermischen Halbwertszeiten erkennbar war, während eine Schaltung mit sichtbarem Licht und eine Resistenz gegenüber Photofatigue ebenfalls zu beobachten ist. Es ist davon auszugehen, dass unsere Benzimidazol-Azo-Arene Einsatz für die Entwicklung von molekularen Werkzeugen finden werden, um räumlich-zeitliche Kontrolle über verschiedene biologische Targets zu erreichen.27
Photoschaltbare Derivate von Verbindung 1 binden selektiv an den CB2R. Unterschiede zwischen den entsprechenden Photoisomeren wurden in verschiedenen biologischen Assays validiert: Das Benzimidazol Azo-Aren 10 d erwies sich als “cis-on” Affinitätsschalter am CB2R (Radioligand-Bindung), verhielt sich aber als ein sub-mikromolarer “trans-on” partiell agonistischer Wirksamkeitsschalter (“efficacy switch”) hinsichtlich der agonistischen Aktivität bei der CB2R Endozytose (konfokale Mikroskopie und Durchfluss-Zytometrie). Ligand 10 d zeigte keinen Effekt auf die G-Protein Aktivierung (PLC/CB2R-vermittelte Ca2+-Freisetzung (Konzentrationen bis zu 30 μM) und CB2R mini-Gαi (Konzentrationen bis 1 μM)). Funktionelle βArr2-Selektivität wurde in einem NanoBiT® βArr2 Rekrutierungs-Assay getestet und durch Messung der CB2R-βArr2-vermittelten Internalisierung bestätigt. Nachgeschaltete Signalwege (ERK1/2 Aktivierung) belegten darüber hinaus das “trans-on”-Wirksamkeitsverhalten von Substanz 10 d. Daher könnte Ligand 10 d – oder zukünftig weitere auf dieser Substanz basierende Liganden – Anwendung bei der Untersuchung von Effekten einer spezifischen Aktivierung des βArr2 Signalwegs am CB2R finden und dadurch dazu beitragen, die Zusammenhänge zwischen diesem spezifischen Signalweg und den dazugehörigen therapeutisch erwünschten Effekten oder auch Nebenwirkungen aufzuklären.
Datenverfügbarkeit
Alle Daten, welche die Befunde dieser Studie untermauern, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.
Danksagung
Die Autoren bedanken sich bei Dr. Andrea Holme, Nadine Yurdagül-Hemmrich und Annette Hannawacker für die exzellente technische Unterstützung und beim Iain Fraser Cytometry Centre (University of Aberdeen) für Zugang zu dessen Ausstattung. Die Autoren bedanken sich weiterhin bei Dr. Matthias Scheiner für seine Beiträge zu der Entwicklung des Kalziummobilisierungsassays und bei Dr. Valérie Jahns für Ihre Bemühungen für eine raschere automatisierte Auswertung der gewonnenen Ergebnisse. Nick Verhavert sei gedankt für seine Unterstützung beim NanoBiT® Assay und Diego Rodriguez-Soacha für die Etablierung des rCB1R Radioligand-Assays in unserem Labor. Besonderer Dank gebührt Dr. Rangan Maitra und RTI International für die Zurverfügungstellung der Gα16-gekoppelten hCB1 und hCB2 CHO-K1 Zelllinien. Das Projekt wurde im Arbeitskreis Decker von der Deutschen Forschungsgemeinschaft großzügig gefördert (DFG DE1546/10-1). J. N. Hislops finanzielle Unterstützung wurde durch NHS Grampian gewährleistet. Der Forschungsaufenthalt von Frau S. A. M. Steinmüller in Dr. Hislops Labor wurde durch das im Internationale Doktorandenkolleg “Rezeptordynamik” (K-BM-2013-247) vom Elitenetzwerk Bayern gefördert, ebenso die Promotionsstellen von J. Fender und A. Tutov. M. H. Deventer wurde durch die Research Foundation-Flanders (FWO; grant 1S54521N) gefördert. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.



 trans,
trans, cis,
cis,
