Einseitige Borat-Veresterung während enzymatischer Nukleosid-phosphorolyse: Scheinbare Gleichgewichtsverschiebungen und kinetische Auswirkungen**
Eine frühere Version dieses Manuskripts ist auf einem Preprint-Server hinterlegt worden (https://doi.org/10.26434/chemrxiv-2022-xjvpw).
Abstract
Biokatalytische Nukleosid(trans-)glykosylierungen mithilfe von Nukleosidphosphorylasen haben sich zu einem praktischen und bequemen Ansatz zur Herstellung von modifizierten Nukleosiden entwickelt, die wichtige Pharmazeutika für die Behandlung verschiedener Krebsarten und Virusinfektionen darstellen. Die bei diesen Reaktionen erzielten Ausbeuten werden jedoch im Allgemeinen ausschließlich durch die inhärenten thermodynamischen Eigenschaften der beteiligten Nukleoside bestimmt, was den biokatalytischen Zugang zu vielen begehrten Nukleosidanaloga erschwert. Wir beschreiben hier einen Ansatz zur Manipulation der Ausbeuten in solchen Reaktionssystemen. Wir zeigen wie eine entropisch getriebene, einseitige Veresterung von Nukleosiden gegenüber Ribosylphosphaten mit anorganischem Borat zu scheinbaren Gleichgewichtsverschiebungen in Phosphorolyse- und Glykosylierungsreaktionen führt. Darüber hinaus beschreiben wir die kinetischen Implikationen einer solchen in situ-Veresterung der Reaktanten für eine Modell-Phosphorylase.
Nukleoside und ihre Analoga sind von zentraler Bedeutung für die biologischen und chemischen Wissenschaften, da sie eine Vielzahl biologischer Funktionen besitzen und eine wichtige Klasse von Pharmazeutika für die Behandlung von Krebs und Virusinfektionen darstellen.1 Obwohl die Synthese von Nukleosiden typischerweise über N-Glykosylierung von Nukleobasen mit stark geschützten Zuckersynthonen erfolgt, hat die Ineffizienz der damit verbundenen Synthesewege in näherer Vergangenheit ein Umdenken angestoßen.2 In den letzten Jahren hat daher das Interesse an der biokatalytischen Synthese natürlicher und modifizierter Nukleoside massiv zugenommen. Aktuelle Beispiele für die chemoenzymatische Synthese von Nukleosidanaloga umfassen unter anderem die Herstellung halogenierter Purinnukleosidsynthone,3 die Diversifizierung alkylierter Pyrimidinnukleosidanaloga,4 die Entwicklung von praktikablen Durchflussverfahren,5 und die Synthese der Wirkstoffe Islatravir (anti-HIV)6 und Molnupiravir (anti-Covid19)7 in biokatalytischen Kaskaden. Alle diese Beispiele verwenden Nukleosidphosphorylasen bei entscheidenden (Trans-)Glykosylierungsreaktionen für die Verknüpfung von Ribosyleinheiten und Pyrimidin- bzw. Purin-Nukleobasen in einem Schritt und ohne die Notwendigkeit von Schutzgruppenchemie.
Nukleosidphosphorylasen katalysieren die reversible Phosphorolyse von Nukleosiden zu den entsprechenden Nukleobasen und Pentose-1-phosphaten (Schema 1).8 Diese Reaktivität kann in umgekerhter Richtung verwendet werden, um in einer gekoppelten Reaktion eine Glykosyleinheit von einem Nukleosid (oder einem Pentose-1-phosphat) auf eine andere Nukleobase zu übertragen. Eine solche Reaktion wird typischerweise als (Trans-)Glykosylierung bezeichnet.9 Obwohl solche (Trans-)Glykosylierungsprozesse als Synthesewerkzeuge gut etabliert sind,10-21 leiden sie inhärent unter thermodynamischen Limitationen, da die Endausbeute dieser Reaktionen ausschließlich von den substratabhängigen thermodynamischen Eigenschaften der jeweiligen (umgekehrten) Phosphorolyseschritte sowie von den angewandten Reaktionsbedingungen bestimmt wird.9, 22, 23 Obwohl einige Fortschritte erzielt wurden, um die strenge thermodynamische Kontrolle in diesen Systemen abzuschwächen oder auszunutzen (beispielsweise durch Fällung eines (Neben-)Produkts,24 die enzymatische Weiterverarbeitung des Produkts25 oder die Anwendung von einem Überschussreagenz, das zurückgewonnen werden kann26), und die irreversible Phosphorolyse von 6-Oxopurinen gut etabliert ist,10, 27, 28 existiert aktuell keine generelle Methode zur direkten Manipulation von Glykosylierungsgleichgewichten.
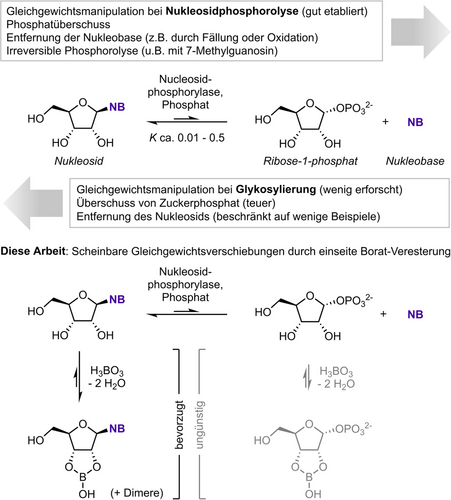
Nukleosidphosphorolyse und Strategien der scheinbaren Gleichgewichtsverschiebung. NB=Nukleobase.
Während unserer Entwicklung des PUB-Moduls für den kontinuierlichen Hochdurchsatz-Phosphatnachweis in biochemischen Assays,29 fanden wir zufällig heraus, dass die Anwesenheit von Borsäure eine Reihe von inhibitorischen Phänomenen während der Phosphorolyse von Pyrimidinnukleosiden bewirkt, sowie eine scheinbare Gleichgewichtsverschiebung. Beide Effekte basieren auf einer einseitigen Veresterung von Borat durch Nukleoside anstatt durch Ribose-1-phosphat (Rib1P). Während Saccharide bekanntermaßen komplexe Gleichgewichtsreaktionen mit Borat in wässriger Lösung eingehen,30, 31 ist vergleichsweise wenig über die in situ-Konkurrenz solcher Prozesse bekannt. Gleichermaßen bietet die Literatur einige Beispiele für biokatalytische Anwendungen von Gleichgewichtsverschiebungsphänomenen durch bevorzugte Veresterung eines Reaktanten mit Borat (die enzymatische Epimerisierung von Fruktose,32 Laktose,33 Galaktose34, 35 und Arabinose36). Jedoch bleiben die genauen Spezies, die an diesen Prozessen beteiligt sind, bislang weitgehend schwer fassbar, ebenso wie die kinetischen Auswirkungen einer solchen Veresterung auf Enzymebene. Trotz der bekannten Fälle für die nicht-kompetitive Inhibition NAD+-abhängiger Enzyme durch Borat,37, 38 sind die Mechanismen dieser Phänomene bislang unbekannt. Um ein ausgiebig charakterisiertes Beispiel für eine einseitige Borat-Veresterung bereitzustellen und um die thermodynamischen und kinetischen Auswirkungen von Boratesterbildung auf Nukleosidphosphorylase-katalysierte Reaktionen aufzuklären, beschreiben wir hier eine Analyse dieses Reaktionssystems mit spektroskopischen und computerchemischen Methoden. Darüber hinaus zeigen wir den synthetischen Nutzen dieser einseitigen Borat-Veresterung, da konzentrationsabhängige scheinbare Gleichgewichtsver-schiebungen einen zusätzlichen Hebel für die Manipulation von Ausbeuten in biokatalytischen Glykosylierungsreaktionen bieten.
Unsere Untersuchung wurde durch die zufällige Beobachtung ausgelöst, dass Phosphorolysereaktionen mit 5-Bromuridin (1 a) in Gegenwart mäßiger Boratkonzentrationen durchweg merklich niedrigere Gleichgewichtsumsätze zeigten als ohne Borat (Abbildungen 1A and B). Zum Beispiel erreichte eine Reaktion mit 400 μM 1 a, 4 mM (10 Äquivalente) Phosphat und 40 μg mL−1 (0.45 mol%) der gut charakterisierten Pyrimidin-Nukleosidphosphorylase von Geobacillus thermoglucosidasius (GtPyNP),4, 39-42 die uns als Modell-Enzym diente (für weitere Details siehe die Hintergrundinformationen), ihr Gleichgewicht bei 70 % Umsatz nach 10 min in Glycin-gepufferter Lösung (Abbildung 1B). Im Gegensatz dazu benötigte die gleiche Reaktion, die zusätzlich 20 mM Borat enthielt, fast 20 Minuten, um ein Gleichgewicht bei 47 % Umsatz zu erreichen, wie eine Analyse durch Mehrwellenlängen-UV-Spektroskopie unter Verwendung von Prinzipien der spektralen Dekonvolution ergab.43, 44 Dieser Effekt war nicht auf eine Enzyminaktivierung zurückzuführen, da GtPyNP in Gegenwart von Borat einen identischen Schmelzpunkt zeigte. Auch nach längerer Inkubation in borathaltigen Puffern konnten wir keinen Verlust seiner katalytischen Aktivität feststellen (Abbildung S1 und S2). Die beobachtete scheinbare Gleichgewichtsverschiebung blieb in der umgekehrten Richtung der Reaktion bestehen (ausgehend von den Produkten Rib1P und 2 a, Abbildung S6). Zusätzliche Experimente zeigten, dass sich dieses Reaktionssystem durchgängig gemäß niedrigeren scheinbaren Gleichgewichtskonstanten der Phosphorolyse (K′) verhielt, deren Größe von der Boratkonzentration abhing (Abbildung 1C). Da solche drastischen Gleichgewichtsverschiebungen für Phosphorolysesysteme atypisch sind, vermuteten wir, dass die Bildung einer dominanten sekundären Spezies das Nukleosid 1 a auf thermodynamisch kontrollierte Weise aktiv aus diesem Gleichgewicht entfernt. In der Tat konnten die Umsatzdaten, die phänotypisch einer Boltzmann-artigen Beziehung folgen (Abbildung 1D), gut mit einem thermodynamischen Modell beschrieben werden, das das Vorhandensein eines zusätzlichen Gleichgewichtssystems berücksichtigt, in dem 1 a teilweise als Boratester vorliegt (Abbildung 1E, für weitere Details und Gleichungen siehe die Hintergrundinformationen). Es ist zwar bekannt, dass Boratester von Ribose auch in verdünnter wässriger Lösung gebildet werden,45-47 allerdings ist in diesen stabilen Estern in der Regel die anomere Hydroxylgruppe beteiligt, die in 1 a fehlt. Dennoch beobachteten Kim et al.48, 49 mittels Massenspektrometrie Boratester des nukleosidbasierten Cofaktors NAD+ sowie der natürlichen Trinukleotide, was darauf hindeutet, dass analoge Spezies durch Rekrutierung der 2′- und/oder 3′-Hydroxylgruppen gebildet werden könnten. Darüber hinaus wurden strukturell ähnliche Nukleosidboronatester von Smietana50, 51 und anderen52 beschrieben. Aufgrund dieser Präzedenzfälle stellten wir die Hypothese auf, dass der zyklische Boratester 1 a* die vorherrschende Spezies ist, die die beobachtete Gleichgewichtsverschiebung verursacht (Abbildung 1F).
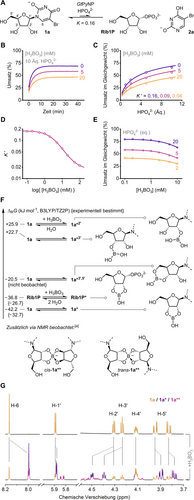
A Phosphorolyse von 5-Bromuridin (1 a) und B–E scheinbare Gleichgewichtsverschiebungen in Gegenwart von Borat. F DFT-Daten. G 1H NMR von 1 a (10 mM) mit und ohne 20 mM Borate in 200 mM Glycinpuffer bei pH 9 und 25 °C. Für experimentelle Details, Rohdaten und Gleichungen siehe die Hintergrundinformationen.58 [a] Wegen ihrer hohen Ladung nicht gut für DFT zugänglich.
Um zu untersuchen, ob Boratester wie 1 a* realistische Spezies sind, um scheinbare Gleichgewichtsverschiebungen unter verdünnten wässrigen Reaktionsbedingungen zu bewirken, unternahmen wir Analysen mit Dichtefunktionaltheorie (DFT)-Rechnungen und NMR-Spektroskopie. DFT-Rechnungen (mit B3LYP/TZ2P53-56 in Kombination mit einem COSMO57 Lösungsmittelmodell für Wasser, siehe Hintergrundinformationen) ergaben, dass die Bildung der 2′- oder 3′-Boratmonoester von 1 a sehr ungünstige Prozesse darstellen. Hingegen bietet die Bildung des vorgeschlagenen fünfgliedrigen zyklischen Diesters 1 a* einen Nettogewinn an Gibbs′scher freier Energie von etwa 40 kJ mol−1. Dies deutet darauf hin, dass diese Veresterung auch gegen den Konzentrationsgradienten von Wasser erfolgen kann (Abbildung 1F). In der Tat konnte ein direkter Nachweis für das Vorhandensein von 1 a* durch NMR-Spektroskopie erbracht werden. Als 1 a (10 mM) mit 20 mM Borat in Glycinpuffer bei pH 9 inkubiert wurde, konnte mittels 11B NMR eine dominante borathaltige Spezies im Gleichgewicht mit freiem Borat beobachtet werden (Abbildung S10). Zusätzlich dazu zeigte 1H NMR zusätzliche Signale, die auf eine Modifikation der Ribosyleinheit von 1 a hinwiesen (Abbildung 1G). Darüber hinaus deuteten geringfügige Änderungen der Kopplungskonstanten im Zuckerring auf die Einführung von Ringtorsion hin, die mit den in 1 a* erforderlichen Konfigurationsänderungen übereinstimmten (Tabelle S4). Neben diesem Ester beobachteten wir zwei verschiedene Nebenkomponenten in der Mischung, die identische Kopplungskonstanten wie 1 a* aufwiesen und in ähnlichen Konzentrationen vorlagen (Verhältnis von ca. 1 : 1.2). Auf der Grundlage der gut charakterisierten diastereomeren Boratesterdimere von Methylapiose, die von Ishii und Ono59 beschrieben wurden, und des Berichts über die Solubilisierung von Purinnukleosiden als 2 : 1-Komplexe mit Borat von Tsuji et al.60 ordnen wir diese Spezies vorläufig den cis- und trans-Isomeren 1 a** zu (Abbildung 1G und F). Insgesamt sind die Gibbs′schen freien Energien, die experimentell durch NMR-Spektroskopie oder Gleichgewichtszustandsberechnungen auf der Grundlage von UV-Daten erhalten wurden (ΔRG ca. −32 kJ mol−1, siehe Hintergrundinformationen für Details) mit denen vergleichbar, die durch DFT-Berechnungen ermittelt wurden. Obwohl ein analoger sechsgliedriger Ester (und möglicherweise seine Dimere) zwischen den 3′- und 5′-Hydroxylgruppen ähnliche Konfigurationsänderungen wie bei 1 a* hervorrufen würde, ergaben DFT-Berechnungen, dass seine Bildung viel weniger exotherm und folglich ungünstiger ist. In ähnlicher Weise ist die Bildung des analogen fünfgliedrigen Boratesters von Rib1P weniger begünstigt als die von 1 a* (eine Voraussetzung für die beobachtete Gleichgewichtsverschiebung), was durch DFT- und NMR-Daten bestätigt wird (Abbildung 1F und S10). Neben dem geringeren entropischen Gewinn gehen wir davon aus, dass sterische Konflikte zwischen der Phosphatgruppe und dem Boratester sowie die Abstoßung von Ladungen die Bildung von Rib1P* im Vergleich zu 1 a* weniger begünstigen. Darüber hinaus zeigte eine NMR-spektroskopische Untersuchung keine Spuren von Dimeren von Rib1P*, was wahrscheinlich auf die sehr ungünstige formale fünffach negative Ladung dieser Spezies zurückzuführen ist. Folglich ist zu erwarten, dass die Bildung des Boratesters 1 a* in direkter Konkurrenz (zu Rib1P*) während einer Phosphorolysereaktion dominiert. Dies konnten wir bestätigen, indem wir Phosphorolyse-Reaktionsgemische mit steigenden Boratkonzentrationen einer Analyse mittels NMR unterzogen (Abbildung S13). Weitere thermodynamische Experimente bestätigten entropische Effekte als treibende Kraft für diese einseitige Veresterung. Arrhenius-Plots des 1 a–1 a*-Gleichgewichts, die durch 1H NMR erhalten wurden, zeigen eine drastische Temperaturabhängigkeit, die das Vorliegen des freien Nukleosids bei höheren Temperaturen begünstigt (Abbildung S11). In Übereinstimmung mit diesen Beobachtungen deuten Arrhenius-Plots für die Boratveresterung, die aus Gleichgewichtsverschiebungen in der Phosphorolyse-Reaktion abgeleitet wurden, auf eine Annäherung an ein energetisches Gleichgewicht zwischen 1 a* und Rib1P* bei höheren Temperaturen hin (Abbildung S5). Insgesamt beschreiben diese Ergebnisse die Spezies 1 a* als den dominierenden Boratester in diesem Reaktionssystem, der in verdünnter wässriger Lösung bei Raumtemperatur freies Nukleosid aus dem Phosphorolyse-gleichgewicht abzieht. Im Einklang mit dieser Schlussfolgerung zeigte das 2′-Deoxy-Nukleosid deoxy-1 a, das nicht in der Lage ist, 1 a* oder 1 a** zu bilden, während seiner Phosphorolyse in Gegenwart von Borat keine Gleichgewichtsverschiebung und keine durch NMR erkennbare Reaktion mit Borat (Abbildung S15).
Als Nächstes versuchten wir, die Ursache für die scheinbar verringerten Reaktionsgeschwindigkeiten in Gegenwart von Borat zu ermitteln, indem wir kinetische Studien und Molekulardynamik (MD)-Simulationen heranzogen. Dieser Effekt war besonders ausgeprägt bei Boratkonzentrationen von mehr als 20 mM und führte zu einer Verringerung der Reaktionsgeschwindigkeit von GtPyNP um mehr als das Vierfache, wie Abbildung 2D zeigt. Da hohe Boratkonzentrationen in erster Linie 1 a* in Lösung ergeben (und nicht das Enzymsubstrat 1 a), stellten wir zunächst die Hypothese auf, dass dieses Phänomen mit der geringeren Konzentration des freien Nukleosidsubstrats und der damit verbundenen scheinbaren Abnahme der Affinität zusammenhängt. Michaelis–Menten–Kinetiken für 1 a (mit Phosphat im Überschuss) erwiesen sich jedoch als widersprüchlich zu dieser Hypothese. Während eine Verringerung der eigentlich verfügbaren Substratkonzentration primär zu einer Erhöhung der beobachteten Michaelis–Menten–Konstante KM führen sollte, beobachteten wir keine Veränderung von KM, sondern stattdessen lediglich einen starken Rückgang der Geschwindigkeitskonstante bei sättigenden Substratkonzentrationen (kcat, Abbildung 2B). Bei sättigenden Konzentrationen beider Substrate wies die beobachtete Geschwindigkeitskonstante kobs eine ähnliche Boltzmann-artige Abnahme auf wie die scheinbare Gleichgewichtskonstante. Dieses Verhalten konnte gut durch ein Gleichgewichtsmodell beschrieben werden, das kobs als eine Funktion von kcat und dem veresterten Anteil von 1 a ausdrückt (Abbildung 2D, für Gleichungen siehe die Hintergrundinformationen). Da diese Abnahme von kobs für deoxy-1 a in Gegenwart von Borat vollständig ausblieb (Abbildung 2C und E), folgerten wir daraus, dass Borat allein keine Hemmung bei GtPyNP auslöst, sondern der Boratester 1 a*. Wenn GtPyNP 1 a* zwar binden, aber nicht umwandeln könnte, wäre davon auszugehen, dass die Position des Gleichgewichts zwischen 1 a und 1 a* das Verhältnis zwischen potenziell aktivem Enzym (1 a gebunden an GtPyNP) und inaktivem Enzym (1 a* gebunden an GtPyNP) bestimmt, vorausgesetzt die Katalyse ist der geschwindigkeitsbestimmende Schritt. In Anbetracht des hochgradig lösungsmittelexponierten aktiven Zentrums von Pyrimidin-Nukleosidphosphorylasen im offenen Zustand erwarteten wir, dass GtPyNP in der Lage sein sollte, den leicht verdrehten und sterisch anspruchsvolleren Boratester 1 a* zu binden und möglicherweise seine Äquilibrierung mit dem freien Nukleosidsubstrat 1 a zu ermöglichen, während er an das Enzym gebunden ist. Phänomenologisch würde ein solcher Prozess einer klassischen nicht-kompetitiven Hemmung ähneln, was mit unseren kinetischen Daten übereinstimmt. MD-Simulationen (mit GROMACS61, 62 und CHARMM3663-Kraftfeld) basierend auf unserer kürzlich beschriebenen Kristallstruktur von GtPyNP mit gebundenem Uridin (PDB ID 7m7k,4 siehe die Hintergrundinformationen für Details) lieferten mehrere Erkenntnisse, die das vorgeschlagene Modell unterstützen. Erstens zeigte eine Analyse der geclusterten Zustände über eine Simulationszeit von 50 ns, dass der Boratester 1 a* in Analogie zu 1 a über Wasserstoffbrücken mit dem Amidmotiv der Nukleobase gebunden werden kann. Zweitens zeigte diese Analyse auch, dass der durchschnittliche Zustand, in dem sich der Enzym-1 a- und der Enzym-1 a*-Komplex während der Simulationszeit befanden, ein recht lösungsmittelexponiertes aktives Zentrum aufwiesen, sodass Veresterungs- und Hydrolyseprozesse möglicherweise in situ stattfinden könnten. Drittens zeigte eine Untersuchung der Abstände zwischen den Domänen, die für den Verschluss der Substratbindetasche verantwortlich sind, eine deutlich geringere Beweglichkeit im Enzym-1 a*-Komplex verglichen mit dem Enzym-1 a-Komplex (Abbildung 2F–H und S19). Während GtPyNP mit gebundenem 1 a oszillatorische Öffnungs- und Schließbewegungen auf einer Zeitskala von etwa 11 ns zeigte (ähnliche Dynamiken sind für die eng verwandten Thymidinphosphorylasen bekannt),64-70 stoppte die Bindung von 1 a* diesen Prozess weitgehend. Unsere Simulationen zeigten, dass dieser Effekt wohl auf ein katalytisch essentielles Arginin zurückgeht, das durch Bindung von 1 a* eine reversible, nach innen gewandte Position einnimmt. Dies scheint die Domänenbewegung in die geschlossene Konformation zu stoppen und das Enzym zu inaktivieren. Zusätzlich behindert die Veresterung der 2′- und 3′-OH-Gruppen von 1 a den Zugang zum anomeren Kohlenstoff, was insgesamt eine produktive Phosphorolyse erschwert. Wie die geclusterten Strukturen ferner zeigen, behindert 1 a* auch leicht den Zugang zur Phosphatbindetasche von GtPyNP. Dementsprechend beobachteten wir zusätzlich zu den niedrigeren kcat-Werten, die aus einer pseudo-nicht-kompetitiven Hemmung durch 1 a* resultieren (Abbildung 2B), experimentell eine verringerte Affinität für Phosphat in Gegenwart von 1 a*. Experimentell ermittelte und berechnete Geschwindigkeitskonstanten für die verschiedenen am Katalysezyklus beteiligten Prozesse erwiesen sich ebenfalls als konsistent mit dem hypothetischen Mechanismus. Das Öffnen und Schließen des Enzyms (ca. 0.1 ns−1) erfolgt auf einer deutlich kürzeren Zeitskala als die Veresterung von 1 a (ca. 3 s−1, Abbildung S12), die Katalyse (ca. 6 s−1) und die Substratbindung durch GtPyNP (ca. 16 s−1, siehe Hintergrundinformationen). Die vergleichsweise langsame Substratfreisetzung (ca. 0.2 s−1) lässt darauf schließen, dass eine in situ-Hydrolyse von 1 a* stattfindet (Hydrolyse-Pathway, Schema 2), obwohl wir erwarten, dass der Reaktionsweg über die Dissoziation von 1 a* und die produktive Bindung von 1 a (Dissoziations-Pathway) ebenfalls in signifikantem Ausmaß stattfindet (siehe Hintergrundinformationen für weitere Diskussion der Inhibitionshypothesen). Im Gegensatz zur Phosphorolyse blieb die Kinetik in Glykosylierungs-Richtung in Gegenwart von Borat im Wesentlichen unverändert (Abbildung S7 und S8), was die untergeordnete Rolle von Rib1P* in diesem Reaktionssystem weiter unterstreicht. Übereinstimmend mit der entropisch getriebenen Bildung von 1 a* aus 1 a beobachteten wir eine verringerte Hemmung der Phosphorolysereaktion bei höheren Temperaturen, wie aus Eyring-Plots hervorgeht, welche bei unterschiedlichen Boratkonzentrationen aufgenommen wurden (Abbildung S9). Insgesamt unterstützen diese Ergebnisse einen Inhibitionsmechanismus, der phänotypisch einer nicht-kompetitiven Hemmung ähnelt, bei der eine schnelle Äquilibrierung von 1 a zum Boratester 1 a* (sowohl in Lösung als auch möglicherweise im Enzym-Substrat-Komplex) den Anteil an katalytisch aktivem GtPyNP reversibel verringert. Dadurch wird der Durchsatz im katalytischen Zyklus hauptsächlich durch die Lage des 1 a–1 a*-Gleichgewichts reguliert (Schema 2). Vorläufige Daten für andere Pyrimidinnukleosid-Phosphorylasen sowie weitere Nukleoside legen nahe, dass dieser Inhibitionsmechanismus wahrscheinlich nicht auf GtPyNP und 1 a beschränkt ist (Abbildung S1 und S18).
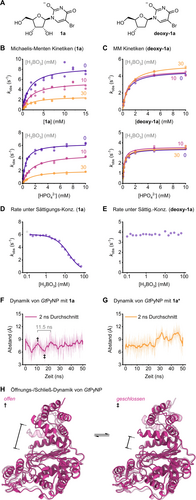
A–C Michaelis–Menten-Plots der Phosphorolyse von 1 a und deoxy-1 a, D und E Rate der Phosphorolyse unter Sättigungskonzentrationen. F–H MD-Simulationen von GtPyNP mit gebundendem 1 a oder 1 a*. Für experimentelle Details, Rohdaten und Gleichungen siehe die Hintergrundinformationen.58
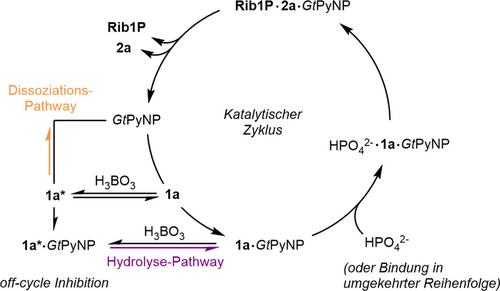
Vorgeschlagener Mechanismus für Geschwindigkeitsabnahmen in Gegenwart von Borat. Zur Vereinfachung sind die Transformationen im Katalytischen Zyklus als unidirektional dargestellt, obwohl sie grundsätzlich reversibel sind.
Basierend auf einem Verständnis der zugrundeliegenden Prozesse, welche die Kinetik und Thermodynamik der Phosphorolyse von 1 a in Gegenwart von Borat bestimmen, strebten wir an, die beobachteten Gleichgewichtsverschiebungen auf Glykosylierungsreaktionen weiterer Nukleoside zu übertragen. Unter der Annahme, dass sich andere Nukleoside analog zu unserem Modellsubstrat 1 a verhalten würden, erwarteten wir, dass Veränderungen der Gleichgewichtszustände in Glykosylierungsreaktionen einen allgemeinen Ansatz zur Verbesserung des Zugangs zu Nukleosiden ausgehend von Rib1P (entweder als isolierte Verbindung vorliegend oder in situ erzeugt) bieten würden.10, 71-73 Tatsächlich legten DFT-Rechnungen für einen repräsentativen Satz von Nukleosiden nahe, dass eine Vielzahl von Pyrimidin- und Purinnukleosiden ähnliche Veresterungen mit Borat eingehen sollten wie 1 a (Tabelle S9). Dies konnte durch 1H NMR (ΔRG ca. −32 bis −34 kJ mol−1, Abbildung S14) und für zwei Beispiele mit kinetischen Experimenten (siehe Hintergrundinformationen und Abbildung S18 für Details) bestätigt werden. Zwar ließen sich, vermutlich aufgrund eines “kinetischen Sperreffekts” (siehe Hintergrundinformationen und Abbildung S17 für Details), die beobachteten kleinen Unterschiede in den Gibbs-Energien nicht zur Manipulation von Umsätzen bei Transglykosylierungen nutzen, jedoch spiegelten Glykosylierungsreaktionen mit verschiedenen Pyrimidin-Nukleobasen 2 a–f das erwartete Verhalten gut wieder. Diese Reaktionen wiesen Steigerungen des Umsatzes um 6 bis 17 % zugunsten des jeweiligen Nukleosids auf (Abbildung 3A). Ein ähnlicher Effekt konnte für das halogenierte Purin 2 g beobachtet werden, wenn es identischen Bedingungen mit der Purinnukleosid-Phosphorylase aus G. thermoglucosidasius ausgesetzt wurde. Eine illustrative Zwei-Faktor-Optimierung für die Glykosylierung von 5-Ioduracil (2 d) und 5-Ethinyluracil (2 f, beide sind bekannt für ihre ungünstigen thermodynamischen Eigenschaften in Glykosylierungsreaktionen)9, 22 zeigte, wie ein Gleichgewicht aus überschüssigem Zuckerdonor und dem Pull-Effekt des zugehörigen Nukleosid-Boratesters zur Verbesserung von anderweitig herausfordernden Nukleobase-Glykosylierungen angewendet werden kann (Abbildung 3B). Beispielsweise konnte die Umwandlung von 2 f zum dazugehörigen Nukleosid 1 f mit 2 Äquivalenten Rib1P durch den Einsatz von 50 mM Borat von 74 % auf 89 % verbessert werden, was herkömmlicherweise 6 Äquivalente Rib1P benötigt hätte. Als Nachweis der synthetischen Anwendbarkeit wurden diese Bedingungen auf den semipräparativen Maßstab übertragen. Die Glykosylierung von 10 mM 2 f mit 2 Äquivalenten Rib1P lief unter heterogenen Bedingungen mit einem Umsatz von 42 % ab, welcher sich durch den Einsatz von 50 mM Borat auf 77 % erhöhte (Abbildung 3C). Die anschließende Aufreinigung durch Umkehrphasen-HPLC ergab eine isolierte Ausbeute von 40 % boratfreiem 1 f aus dieser Mischung.
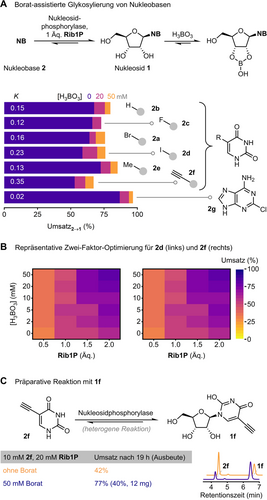
Glykosylierungsexperimente in Gegenwart von Borat. K bezieht sich auf die Gleichgewichtskonstante der Phosphorolyse, aus Referenz [22]. Der Umsatz bezieht sich grundsätzlich auf die Umwandlung der Nukleobase 2 in das Nukleosid 1 und den zugehörigen Spezies.
Zusammenfassend haben wir das Gleichgewicht zwischen Ribonukleosiden und ihren entsprechenden 2′,3′-Boratestern in wässriger Lösung beschrieben. Dieses Phänomen ermöglicht scheinbare Gleichgewichtsverschiebungen in Nukleosidphosphorolyse- und Glykosylierungsreaktionen aufgrund einer einseitigen Borat-Veresterung von Nukleosiden gegenüber dem Zuckerphosphat Rib1P. Zusätzlich verursacht diese Borat-Veresterung auch eine Reduzierung der Phosphorolyserate von Pyrimidinnukleosid-Phosphorylasen, welche sehr wahrscheinlich über eine Bindung des Nukleosid-Boratesters an das Enzym und die anschließende hydrolytische Umwandlung in das freie Substrat abläuft. Die hier beschriebenen Effekte beleuchten die Aktivität von Nukleosid-bindenden Enzymen in Gegenwart von Borat und liefern einen zusätzlichen Ansatz zur Manipulation von Gleichgewichten in Nukleobase-Glykosylierungsreaktionen. Wir vermuten, dass ähnliche Prozesse in der Hemmung von NAD+-abhängigen Oxidoreduktasen sowie bei den zuvor berichteten Gleichgewichtsverschiebungen in verschiedenen (chemo-)enzymatischen Zucker-Epimerisierungen eine Rolle spielen.
Danksagung
Die Autoren danken der NMR-Abteilung der TU Braunschweig sowie Samantha Voges (TU Berlin) für die Unterstützung bei den spektroskopischen Experimenten und Dr. M. Rhia. L. Stone (Rutgers University) für die Kommentare zum Manuskript. F.K. ist gefördert durch die Deutsche Forschungsgemeinschaft (DFG), Projektnummer 492196858. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




