Einsatz der kooperativen Katalyse für die Oberflächensynthese linearer heteroaromatischer Polymere durch selektive C-H-Aktivierung
Abstract
Die regiospezifische C-H-Aktivierung ist ein vielversprechender Ansatz, um ausgedehnte Polymere mit maßgeschneiderten Strukturen zu erhalten. Bei einem neueren synthetischen Ansatz, der die regioselektive Homokupplung von heteroaromatischen Molekülen auf der Oberfläche ermöglicht hat, wurden jedoch nur kleine Oligomere erreicht. In diesem Artikel wird zum ersten Mal über die selektive C-H-Aktivierung für dehydrierende C-C-Kupplungen von Hexaazatriphenylen durch die Scholl-Reaktion berichtet. Durch die Kombination von Niedertemperatur-Rastertunnelmikroskopie (RTM) und Rasterkraftmikroskopie (RKM) konnten wir die Bildung von eindimensionalen Polymeren mit einer Doppelkettenstruktur nachweisen. Die Details des Wachstumsprozesses werden durch Dichtefunktionaltheorie (DFT)-Berechnungen beleuchtet, die auf eine kooperative katalytische Wirkung von Na- und Ag-Atomen bei der Steuerung der C-H-Selektivität für die Polymerisation hinweisen.
Die dehydrierende Kupplungsreaktion zweier Arenringe und die ringschließende Cyclodehydrierung, die durch nicht-oxidierende Lewis-Säuren vermittelt wird (Scholl-Reaktion), sowie die analoge oxidative, aromatische Kupplungsreaktion nehmen in der synthetischen Chemie polyzyklischer (hetero)aromatischer Verbindungen eine herausragende Stellung ein.1-4 Diese Syntheseprotokolle sind besonders vorteilhaft, da Biarylbindungen ohne Vorfunktionalisierung der Vorläufermoleküle gebildet werden können. Es überrascht nicht, dass sich die Scholl-Reaktion als besonders nützlich für die Bildung mehrerer kondensierter Ringe erwiesen hat, um polyzyklische Arene und Nanographenverbindungen zu erhalten.5-9 Der Schritt der C-H-Aktivierung/Arylierung bei der Synthese polyzyklischer aromatischer Kohlenwasserstoffe (PAK) ist jedoch im Allgemeinen nicht sehr selektiv, da die C-H-Bindungen nicht nur eine geringe intrinsische Reaktivität aufweisen, sondern auch nur geringe relative Unterschiede in ihrer Reaktivität.9, 10 Ergänzend zur etablierten Scholl-Reaktion in Lösung zeigt der analoge, oberflächenunterstützte C-C-Kopplungsprozess eine erstaunliche Effizienz bei der Herstellung von Nanographen- und anderen Strukturen im atomaren Maßstab.11-13 Bei der intramolekularen Bindungsbildung findet der Cyclodehydrierungsprozess zwischen zwei nahe beieinander liegenden Arenringen statt, so dass die Regioselektivität weitgehend kontrolliert werden kann.12, 14-16 Für den intermolekularen Fall kann die Bindungsselektivität der dehydrierenden Aryl-Aryl-Kopplung jedoch nicht a priori vorhergesagt werden, wenn die Moleküle mehrere C-H-Bindungen enthalten.17-19
Kürzlich wurde die Selektivität bei der Aryl-Aryl-Kopplung untersucht, indem die Regioselektivität der Oberflächen-Homokopplung von tetraazapolyzyklischen Pyrazino[2,3-f:4,7]phenanthrolin-Molekülen (pap) auf einem Au(111)-Substrat ausgenutzt wurde.20 Dort wurde berichtet, dass die C-H-Bindungsspaltung eindeutig regiospezifisch ist, da die ortho-Wasserstoffatome der Pyrazinringe gegenüber ihren Pyridinäquivalenten bevorzugt aktiviert werden, wie durch Rastertunnel- (RTM) und Rasterkraftmikroskopie (RKM) gezeigt wurde.20 Die daraus resultierenden kovalenten Strukturen waren jedoch in ihrer Größe begrenzt und beschränkten sich auf kleine Cluster, die hauptsächlich aus Dimeren, Trimeren und Tetrameren bestanden. Mit diesem Ansatz lässt sich zwar die Selektivität der Scholl-Reaktion steuern, aber es werden immer noch neue Strategien für die Synthese von längeren Polymeren benötigt. Die kooperative Katalyse, bei der mehrere Katalysatoren und katalytische Zyklen synergetisch zusammenwirken, um die Bildung von Einzelbindungen zu fördern, ist ein attraktiver Ansatz, um neue Reaktionsschemata zu erreichen.21-23 Ihr Potenzial im Bereich der Oberflächensynthese ist jedoch noch weitgehend unerforscht.
Hier berichten wir über ein oberflächengestütztes Syntheseprotokoll, das zu einer selektiven C-H-Aktivierung für dehydrierende C-C-Kopplungen von Hexaazatriphenylen (HAT)-Molekülen führt,24 was in Gegenwart von Na-Atomen auf einer Ag(111)-Oberfläche zu linearen heteroaromatischen Polymeren führt (Schema 1). Jede HAT-Kette weist zusammenhängende, zweizähnige N^N-Koordinationstaschen auf, die durch cisoide Konformation der Catena-2,2′-(1,10-Phenanthrolin)-Skelette entlang der Kette entstehen. Zwei Ketten sind durch die Na-Koordination an N^N-Chelat-Taschen parallel zueinander ausgerichtet. Zuvor wurde beobachtet, dass die Koordination von Goldatomen an eine vierzähnige N^N-Tasche eine cisoide Konformation für die Bildung eines pap-Dimers bewirkt, von denen zwei ebenfalls durch die Koordination von zwei Goldadatomen an N^N-Taschen parallel ausgerichtet sind.20 In ähnlicher Weise wurde eine cisoide Konformation von 2,2′-Bipyridin an der Oberfläche nachgewiesen, die durch Metallkoordination ausgelöst wird.25 Insbesondere wird ein Chelatkomplex mit einem einzelnen Na-Atom gebildet, wenn ein π-konjugiertes Tetrathiafulvalen-kondensiertes Dipyridophenazin-Molekül auf NaCl/Cu(111) adsorbiert wird.26 In der vorliegenden Studie ist das Wachstum von zwei koordinativ gebundenen HAT-Ketten, die gleich lang sind, auf eine regiospezifische Homokopplung eines (HAT)2-Na-Dimers durch selektive Aktivierung der C-H-Bindungen in den meta-Positionen zur N^N-Chelatierungstasche zurückzuführen. Mit anderen Worten, diese Polymerisation wird durch die Komplexierung mit Na unter Bildung eines (HAT)2-Na-Dimers eingeleitet, wobei die anschließende C-H-Aktivierung mit hoher Selektivität durch einzelne Ag-Atome katalysiert wird und schließlich über die dehydrierende Aryl-Aryl-Kopplung zu einer Doppelkettenstruktur führt.
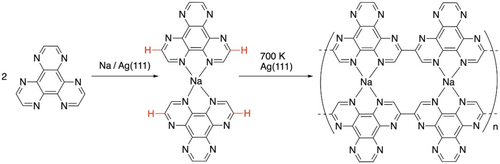
Schematische Darstellung der oberflächenunterstützten Polymerisation von HAT-Molekülen in Gegenwart von Na. Benachbarte Ketten sind über zusammenhängende N^N-Koordinationstaschen ausgerichtet, die vierfache Koordinationsstellen für Na bieten.
Die Adsorption von HAT-Molekülen auf eine Ag(111)-Oberfläche bei ≈10 K und das anschließende Tempern auf 300 K (Abbildung 1a) führen zu ausgedehnten Kristallen, die hauptsächlich aus selbstorganisierten Monoschichtinseln bestehen.24 Ein anschließendes Erhitzen auf 700 K führt zur vollständigen Desorption der Moleküle (Abbildung 1b). Ein anderes Verhalten wird beobachtet, wenn eine NaCl-Submonolage (ML) zusammen mit den HAT-Molekülen aufgedampft wird (Abbildung 1c). Beim anschließenden Tempern auf 700 K wurden keine NaCl-Inseln beobachtet, jedoch sind Polymere auf der Ag-Oberfläche zu finden (Abbildung 1d), die die Stufenkanten bedecken und sich auf die flachen Terrassen erstrecken. Eine Nahaufnahme der Polymere mittels RTM-Bildgebung (Abbildung 2a) zeigt, dass die Produkte aus linearen Strukturen bestehen (siehe Abbildung S1).

Synthese von heteroaromatischen Polymeren auf der Oberfläche. a), b) RTM-Bilder, die nach dem Erhitzen auf 300 K (a) einer sub-Monolage von HAT auf Ag(111) (a) aufgenommen wurden und ausgedehnte selbstorganisierte Monolagen mit kleinen Doppelschichtinseln zeigen, und nach Erhitzen auf 700 K (b). c), d) RTM-Bilder, die nach dem Erhitzen auf 300 K (c) und 700 K (d) einer Teilmonolage aus HAT und NaCl (0.3 ML) auf Ag(111) aufgenommen wurden. Alle Bilder wurden im RTM-Modus mit konstantem Strom aufgenommen. a) Messparameter: Tunnelstrom I=1.7 pA, Probenvorspannung V=1.0 V. b) I=1.9 pA, V=1.0 V. c) I=1.4 pA, V=1.5 V. d) I=1.1 pA, V=1.0 V.
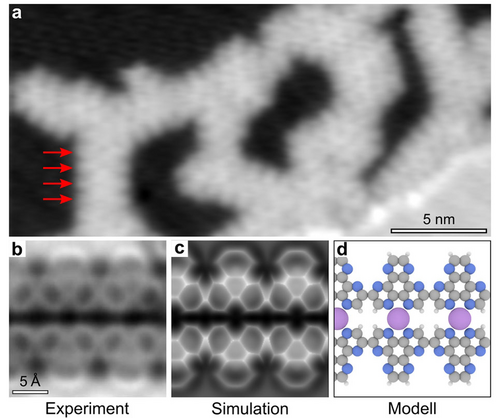
Lineare heteroaromatische Polymere. a) Konstantstrom-RTM-Bild einer Ag(111)-Oberfläche, die mit einer Submonolage aus HAT und NaCl (0.3 ML) bedeckt ist, nach dem Erhitzen auf 700 K. Die Pfeile zeigen die Positionen der Monomere in einer linearen Kette an (I=1.3 pA, V=1.0 V). b) RKM-Bild, mit konstanter Höhe Δf mit einer CO-funktionalisierten Spitze bei Δz=2.7 Å, bezogen auf einen RTM-Sollwert von (I=1.1 pA, V=0.1 V) aufgenommen. RKM-Oszillationsamplitude A=0.5 Å. c), d) Simuliertes RKM-Bild bzw. Strukturmodell. d) Graue, blaue, weiße und violette Kugeln stellen Kohlenstoff-, Stickstoff-, Wasserstoff- bzw. Natriumatome dar.
Diese experimentellen Beobachtungen werfen die Frage auf, welche Rolle der mitabgeschiedene NaCl-Film bei der Ermöglichung eines Reaktionsweges für die dehydrierende C-C-Kopplung der HAT-Moleküle spielt. Bei der thermischen Behandlung von gemeinsam abgeschiedenen HAT- und NaCl-Submonolagen auf Ag-Oberflächen zerfällt das Ionengitter (siehe XPS-Daten in Abbildung S2), wobei Cl− in Form von flüchtigen AgCl-Spezies desorbiert wird,27 während ein Teil des Na auf der Oberfläche verbleibt.28 Dies deutet auf eine mögliche Rolle der Na-Atome in der Polymerisationsreaktion hin. Spontane Dissoziation von NaCl und anschließende Koordination von Na-Adatomen mit organischen Molekülen wurde bereits beim Erwärmen von Oberflächen bei erhöhten Temperaturen beobachtet.28-32 Doch abgesehen von einfachen intramolekularen Reaktionen wie der tautomeren Isomerisierung von Guanin33 und der Deprotonierung von Terephthalsäure,34 wurde bislang keine Na-unterstützte intermolekulare Kopplung festgestellt.
Detaillierte Einblicke gewährt die RKM-Bildgebung mit einer CO-funktionalisierten Spitze.35 Der Kontrast im RKM-Frequenzverschiebungsbild (Δf) (Abbildung 2b) verdeutlicht die Bildung kovalenter Bindungen zwischen den HAT-Molekülen, wobei die Aktivierung der Wasserstoffatome in meta-Positionen zu den chelatbildenden N-Atomen zu kovalent gebundenen linearen Strukturen führt (Abbildung 2b). Bemerkenswert ist, dass jede Kette mit einer parallelen Kette gekoppelt ist, was auf das Vorhandensein atomarer Spezies hinweist, die an benachbarte N^N-Chelat-Taschen koordinieren. Aufgrund der geringeren Adsorptionshöhe im Vergleich zu den Molekülstrukturen können diese jedoch nicht durch RKM-Aufnahmen mit konstanter Höhe aufgelöst werden.36, 37 Da sowohl Na- als auch Ag-Atome potenziell mit den HAT-Molekülen koordinieren können, ist die chemische Identifizierung der atomaren Spezies entscheidend. Nach der Adsorption der HAT-Moleküle auf der blanken Ag(111)-Fläche und dem Erwärmen auf 300 K zeigte die hochauflösende RKM-Bildgebung die Bildung rein H-gebundener Strukturen ohne Hinweise auf metallorganische Strukturen mit Ag-Adatomen.24 Dies deutet darauf hin, dass die Koordinierung der HAT-Moleküle mit Ag-Atomen nicht günstig ist, selbst bei recht hohen Temperaturen, bei denen native Oberflächenatome reichlich verfügbar sind.38 Dies weist auf den Einbau von Na-Atomen in die chelatbildenden N^N-Taschen hin. Dieses Szenario wird auch durch das simulierte RKM-Bild mit konstanter Höhe39 in Abbildung 2c unterstützt, das unter Verwendung der vollständig relaxierten atomaren Struktur des an Na koordinierten HAT-Polymers auf der Ag(111)-Oberfläche erhalten wurde (Abbildung 2d).
Es wurden quantenmechanische Berechnungen durchgeführt, um einen möglichen Reaktionsmechanismus und die Regioselektivität von HAT-Molekülen zu eindimensionalen Polymeren aufzuklären. Wir untersuchten zunächst die Rolle der Na-Atome bei der Bildung der Polymerkette. Um die Bedeutung von Na zu verstehen, wurde die Wechselwirkung von Na- und Ag-Atomen mit dem Monomer und dem Dimer von HAT-Molekülen auf der Ag(111)-Oberfläche verglichen. Während die berechnete Hirshfeld-Ladung eines Ag-Atoms (+0.04 e) vernachlässigbar ist, was auf dessen neutralen Charakter hindeutet, hat das Na-Atom eine bemerkenswerte positive Ladung (+0.35 e). Dies deutet auf einen kationischen Charakter der Natrium-Adatome auf der Oberfläche hin (siehe Tabelle S1). Die berechneten Bindungsenergien von Na- und Ag-Atomen an HAT-Moleküle zeigen sowohl für monomere als auch für dimere Komplexe eine größere Bindungsenergie für das Na-Atom (siehe Tabelle S2). Dies zeigt, dass ein organometallisches Dimer, bestehend aus zwei HAT-Molekülen und einem Na-Atom dazwischen, das stabilste System ist. Abbildung 3 zeigt die berechnete differentielle Elektronendichte (Δρ), definiert als Δρ=ρgesamt−ρkomplex−ρAg(111), wobei ρgesamt, ρkomplex und ρAg(111) die Elektronendichten des entspannten Komplexes an der Oberfläche, des Komplexes in der Gasphase bzw. der blanken Ag(111)-Oberfläche sind. Die räumliche Verteilung von Δρ weist auf das Vorhandensein von Koordinationsbindungen zwischen Na- und N-Atomen der HAT-Moleküle hin (siehe auch Abbildung S3). Die DFT-Gesamtenergieberechnungen des dimeren (HAT)2-Na-Komplexes zeigen starke Wechselwirkungen mit der Ag(111)-Oberfläche, was durch einen ausgeprägten Ladungstransfer von den HAT-Liganden zum Substrat bestätigt wird, der die Bindungsenergie (siehe Tabelle S2) des Dimers auf dem Ag(111)-Substrat erhöht. Insbesondere erhöht die Bildung des (HAT)2-Na-Komplexes die Desorptionstemperatur im Vergleich zu reinen HAT-Molekülen erheblich, so dass vor der Desorption von der Oberfläche höhere Reaktionstemperaturen erreicht werden können. Somit ermöglicht die Natriumkomplexierung das Erreichen höherer Temperaturen, was die Bedingungen für die Polymerisationsreaktion erleichtert.
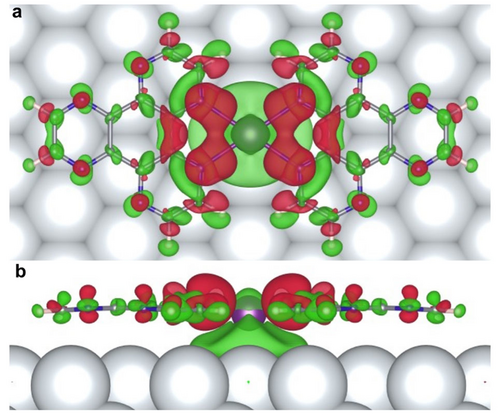
Berechneter Ladungstransfer zwischen dem (HAT)2-Na-Komplex und der Ag(111)-Oberfläche. Die differentielle Elektronendichte (Δρ) ist bei einer Isofläche von 0.005 e Å−3 dargestellt. Grüne und rote Farbe stehen für negative bzw. positive Werte von Δρ. Die räumliche Verteilung von Δρ deutet auf starke Wechselwirkungen zwischen dem (HAT)2-Na-Komplex und Ag(111) durch einen ausgeprägten Ladungstransfer von den HAT-Liganden auf Ag(111) hin. (a, b) Draufsicht und Seitenansicht.
Es ist offensichtlich, dass die Polymerisation durch Entkopplung von Wasserstoffatomen eingeleitet werden muss, um ein freies Radikal zu bilden, das die intermolekulare kovalente Kopplung zwischen den HAT-Einheiten einleitet. Daher analysierten wir zunächst die Bindungs-Dissoziations-Energien (BDE) für die drei nicht äuqivalenten Wasserstoffatome in den monomeren (HAT)1-Na- und dimeren (HAT)2-Na-Komplexen, wie in Abbildung 4a,b dargestellt. Die berechneten BDE-Werte weisen auf eine bevorzugte Wasserstoffentkopplungin der Nähe des Na-Atoms hin. Diese BDE-Werte sind in beiden Fällen (95.6 kcal mol−1 für das Monomer und 92.4 kcal mol−1 für das Dimer) niedriger als der berechnete BDE-Wert für ein freies HAT-Molekül (112.2 kcal mol−1), aber immer noch zu hoch für eine temperatur-induzierte direkte C-H-Bindungsspaltung. Daher wurde die Möglichkeit in Betracht gezogen, dass die C-H-Bindungsspaltung durch ein Ag-Adatom vermittelt wird, das als Katalysator wirkt. Tatsächlich wurde kürzlich gezeigt, dass solche mobilen Adatome, die bei hohen Temperaturen häufig auf Metalloberflächen vorhanden sind, wichtige Reaktionsschritte wie die tautomere Dehydrierung von Keto-Enol,40 und die C-C-Kopplung fördern.41-43 Daher haben wir QM/MM44-Berechnungen der freien Energie mit der WHAM-Methode45 durchgeführt, um diese Hypothese zu untersuchen. Tatsächlich zeigen die QM/MM-Simulationen eine erhebliche Verringerung der Aktivierungsenergien um ≈60 kcal mol−1. Wir haben festgestellt, dass die niedrigste Aktivierungsenergiebarriere für die Dehydrierung in meta-Position eines Moleküldimers berechnet wird, 35.4 kcal mol−1 (grün in Abbildung 4c, d). Die Aktivierungsenergien für die ortho- (blau in Abbildung 4c, d) und para-Position (rot in Abbildung 4c, d) sind etwas höher und betragen 41.9 bzw. 50.2 kcal mol−1. Zwischen dem Dimer (HAT)2-Na und dem Monomer (HAT)1-Na (55 kcal mol−1, Abbildung S4) ist das Dimer nicht nur die stabilste Struktur, sondern weist auch eine um 20 kcal mol−1 niedrigere Aktivierungsenergie auf. Diese Ergebnisse deuten auf eine kinetisch bedingte Regioselektivität mit einer Neigung des Systems zur Polymerisation in der Richtung senkrecht zum (HAT)2-Na-Komplex hin, wodurch zwei parallele 1D-Ketten entstehen, die von Na in tetradentater N^N-Position zusammengehalten werden. Es ist zu betonen, dass die Wasserstoffentkopplungin Abbildung 4 nur der erste Reaktionsschritt auf dem Weg zum Polymer ist. Der resultierende (HAT)2-Na-Radikalkomplex ist aufgrund der energetischen Bevorzugung der Wasserstoffentkopplung an den meta-Positionen sehr zugänglich für die Bildung kovalent gebundener Komplexe mit benachbarten (HAT)2-Na-Radikalen und nicht mit HAT selbst. Daher können wir davon ausgehen, dass das Wachstum linearer polymerer Strukturen durch die Kopplung von (HAT)2-Na-Komplexen und nicht durch die Bindung einzelner HAT-Radikale erfolgt. Dieses Szenario wird durch die experimentelle Beobachtung von Polymeren unterstützt, die aus zwei gleich langen Ketten bestehen, was darauf hindeutet, dass die Polymere direkt als gekoppelte Ketten wachsen und nicht durch Kettenpaarung beim Abkühlen entstehen.
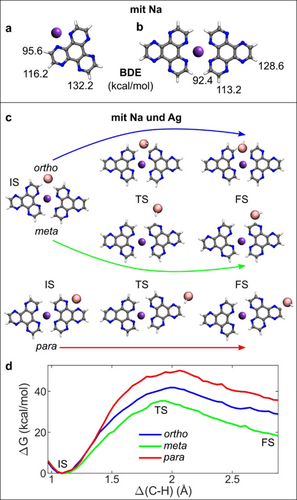
HAT-Na-Komplexe: (HAT)1-Na (a) und (HAT)2-Na (b). Dargestellt sind die Bindungsdissoziationsenergien (BDE) für drei ungleiche Wasserstoffatome. Kooperative Rolle von Na und Ag (c, d). Reaktionswege für die Wasserstoffentkopplung in ortho-, meta- und para-Konfigurationen (c). Entsprechende Berechnungen der freien Energie als Funktion des C−H-Abstands (Δ) der aktivierten Bindung (d). Ausgangszustand (IS), Übergangszustand (TS) und Endzustand (FS) sind angegeben (c, d).
Zusammengefasst untersuchten wir die Oberflächenpolymerisation von HAT-Molekülen auf Ag(111) in Gegenwart von Na-Atomen, die zur Bildung eindimensionaler Strukturen aus gekoppelten Polymerketten führt. Durch die Kombination von hochauflösender Rastersondenmikroskopie mit DFT-Berechnungen haben wir die besondere kooperative katalytische Rolle von Na- und Ag-Atomen bei der Steuerung sowohl der Polymerisation als auch der Regioselektivität der Scholl-Reaktion aufgeklärt. Unsere Ergebnisse ebnen den Weg für weitere Studien zu kooperativen katalytischen Effekten von Metalladatomen bei der Steuerung neuartiger Kopplungsreaktionen an Oberflächen.
Danksagung
Für die finanzielle Unterstützung durch die Deutsche Forschungsgemeinschaft (DFG), Projekt-IDs RE2669/7 und PA3628/1, danken wir. Diese Arbeit wurde von Praemium Academie der Akademie der Wissenschaften der Tschechischen Republik und GACR 20-13692X (P.J., P.M., A.M.), dem Swiss NSF Grant 200021_204053 (S.-X.L.) und den Swiss NSF Professorship Grants PP00P2_157615 und PP00P2_187185 (U.A.) unterstützt. Wir danken der Forschungsinfrastruktur des CzechNanoLab, das von MEYS CR (LM2018110) unterstützt wird. A.M. bedankt sich für die Unterstützung durch die interne Studienförderung der Palacký Universität in Olomouc, Tschechische Republik, IGA_PrF_2021_031. Die Rechenressourcen wurden von CESNET LM2015042 und der CERIT Scientific Cloud LM2015085 bereitgestellt, die im Rahmen des Programms “Projects of Large Research, Development, and Innovations Infrastructures” bereitgestellt wurden. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




