Einlagerung und Abtrennung von SO2-Spuren in Metall-organischen Gerüstverbindungen durch präsynthetische Anpassung der Porenumgebung mit Methylgruppen
Abstract
Wir berichten über eine präsynthetische Porenumgebungs-Design-Strategie zur Herstellung stabiler Methyl-funktionalisierter Metall-organischer Gerüstverbindungen (MOFs) für eine bevorzugte SO2-Bindung und damit verbesserte SO2-Adsorption bei niedrigem (Partial-)Druck und SO2/CO2-Trennung. Die verbesserte Sorptionsleistung wird erstmals auf eine optimale Porengröße durch Erhöhung der Methylgruppendichte am Benzoldicarboxylat-Linker in [Ni2(BDC-X)2DABCO] (BDC-X=Mono-, Di- und Tetramethyl-1,4-benzoldicarboxylat/Terephthalat; DABCO=1,4-Diazabicyclo[2,2,2]octan) zurückgeführt. Monte-Carlo-Simulationen und Ab-initio-Dichtefunktionaltheorie(DFT)-Berechnungen zeigen die Schlüsselrolle der Methylgruppen innerhalb der Porenoberfläche für die bevorzugte SO2-Affinität gegenüber dem Stamm-MOF. Das SO2-Abtrennungspotential durch Methyl-funktionalisierte MOFs wurde durch Gas-Sorptionsisothermen, IAST-Berechnungen, simulierte und experimentelle Durchbruchskurven und DFT-Berechnungen validiert.
Einleitung
Die Emission des giftigen Gases Schwefeldioxid (SO2) stellt eine schwerwiegende Umweltverschmutzung dar, bedroht die menschliche Gesundheit und wirft verschiedene ökologische Probleme auf.1-4 Obwohl ein großer Teil (ca. 95 %) des SO2 durch etablierte Entschwefelungstechnologien wie die Kalksteinwäsche aus den Rauchgasen entfernt wird,1, 5 verbleibt das restliche SO2 im Rauchgas und kann andere Gaswäscher beschädigen.6, 7 Eine Möglichkeit im Hinblick auf die Prozessökonomie und Energieeffizienz kann die Entwicklung neuer Technologien auf der Basis fester Adsorbentien zur SO2-Entfernung im Spurenbereich sein.8-11 Angesichts der hochgradig korrosiven Natur von SO2 sind viele Materialien empfindlich gegenüber SO2, weshalb relativ wenige Studien zu ionischen Flüssigkeiten,12 Zeolithen,13 porösen organischen Käfigen14 und metall–organischen Gerüstverbindungen (MOFs)15-21 durchgeführt wurden. Unter ihnen scheinen MOFs aufgrund ihrer herausragenden Eigenschaften, wie die Synthese von Netzwerken, einstellbare Struktur und hohe Porosität, am vielversprechendsten.22-25 Bis jetzt wurde nur über eine geringe Anzahl von MOFs zur SO2-Adsorption berichtet,26-28 im Vergleich zur CO2- und CH4-Sorption. Noch weniger wurde über die gezielte SO2-Spurenentfernung, d. h. eine hohe SO2-Aufnahme bei niedrigem Partialdruck, berichtet. Im Allgemeinen wird die Kapazität der SO2-Spurenentfernung durch die SO2-Aufnahme bei einem Partialdruck von 0,1 bar oder 0,01 bar bestimmt.
Bislang wurden zwei Hauptstrategien für eine erhöhte SO2-Affinität von MOFs vorgeschlagen: zum einen offene Metallstellen innerhalb der MOF-Struktur für M-SO2-Wechselwirkungen,29, 30 zum anderen polare Aminogruppen im Gerüst für Wasserstoffbrückenbindungen zu SO2.31, 32
Darüber hinaus wurde kürzlich darauf hingewiesen, dass kleine Mikroporen-Durchmesser im Bereich von ca. 4 bis 8 Å für die Niederdruck-SO2-Aufnahme vorteilhaft sein könnten.33
MOFs mit Methyl-funktionalisierten Linkern könnten geeignete Kandidaten sein, um Mikroporen-Durchmesser auf den optimalen Bereich zuzuschneiden und gleichzeitig moderate nicht-kovalente Van-der-Waals(vdW)-Wechselwirkungen zu SO2-Molekülen für ausreichende SO2-Affinität zu bilden, aber dennoch einfach (desorbierend) regenerierbar zu sein. Methyl-funktionalisierte MOFs zeigen nachweislich eine erhöhte Affinität zur CO2-Aufnahme,34, 35 wurden aber unseres Wissens nach nicht für die SO2-Sorption und -Abscheidung untersucht. Wir schlagen vor, dass MOFs mit einer bereits realisierten Topologie durch Methyl-Funktionalisierung in ihrem Porendurchmesser für eine effiziente SO2-Abtrennung modifiziert werden könnten. Gleichzeitig erhöhen Methylgruppen die Hydrophobie und können die reaktiven Metall-Linker-Bindungen abschirmen, um die Stabilität der MOFs gegenüber Feuchtigkeit zu erhöhen.25, 36
Unseres Wissens nach gibt es keine Berichte über die Verwendung von Methylgruppen zur Erhöhung der SO2-Affinität und SO2/CO2-Selektivität. In dieser Arbeit untersuchen wir systematisch den Methyl-funktionalisierten BDC-Linker in den Säulen-verbundenen Schichten von [Ni2(BDC-X)2DABCO] {BDC-X=Monomethyl- (X=M), 2,5-Dimethyl- (X=DM) und Tetramethyl-1,4-benzoldicarboxylat (X=TM)/Terephthalat; DABCO=1,4-Diazabicyclo[2,2,2]octan}, bezeichnet als DMOF-X (Abbildung 1).37, 38 DMOFs mit verschiedenen Metallen und Linkern, Gemischt-Metallen und Gemischt-Linkern, einschließlich BDC-TM und Ni-DMOF-TM, wurden kürzlich auf SO2-Sorption getestet, wobei der Schwerpunkt auf der Stabilität unter feuchten Bedingungen lag.25 Die Zugabe von Methylgruppen zum BDC-Linker führt zu isostrukturellen DMOFs.39 Die erhöhte Dichte an Methylgruppen in Methyl-funktionalisierten DMOF-X (X steht für M, DM und TM) wird dann mit den SO2-Adsorptions- und Trenneigenschaften korreliert.
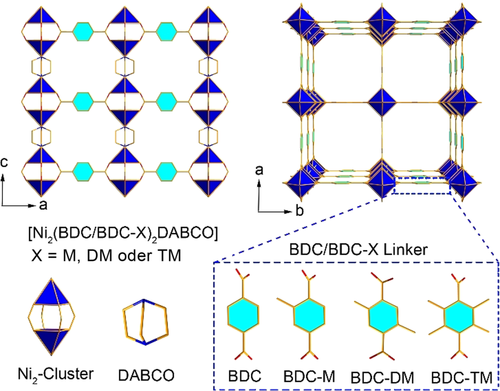
Obere Reihe: Schnitte durch das Packungsdiagramm von DMOF, die die Kanalstrukturen entlang der b- (und identischen a-)Achse und entlang der c-Achse zeigen. Untere Reihe: Bausteine des Ni2-Clusters, DABCO und BDC/BDC-X in DMOF/DMOF-X. X steht für die Substituenten Monomethyl (M), 2,5-Dimethyl (DM) oder 2,3,5,6-Tetramethyl (TM). Wasserstoffatome wurden zur Verdeutlichung weggelassen.
Ergebnisse und Diskussion
[Ni2(BDC)2DABCO]-DMOF besteht aus zweikernigen Nickel-Schaufelrad-Einheiten, {Ni2(OOC-)4}, die durch BDC-Linker verbrückt sind, um regelmäßige quadratische 2D-Schichten zu bilden, die durch DABCO-Linker als Säulen zu einem 3D-Gerüst verbunden sind (Abbildung 1). Somit existieren zwei Arten von Kanälen in dieser DMOF-Struktur. Einer ist der breite quadratische Kanal mit ca. 7,5×7,5 Å2 entlang der c-Achse (Abbildung 1, oben rechts), während der andere eine schmalere rechteckige Öffnung mit ca. 5,6×6,9 Å2 entlang der a- und b-Achse ist (Abbildung 1, oben links).37 Die Einführung von vier Methylgruppen mit dem Tetramethylterephthalat-Linker minimiert den Bereich der Porenbreite in DMOF von ca. 6–8 Å auf ca. 5–7 Å in DMOF-TM (wie aus der Ar-Sorption bestimmt, Abbildung S11, SI). Dies stimmt mit den Porenbreiten entlang der c-Achse und a/b-Achse in der DMOF-TM-Kristallstruktur von ca. 4,9×4,9 Å2 bzw. ca. 4,5×6,7 Å2 überein.39 In BDC-TM dreht sich die Tetramethylphenylgruppe aufgrund der sterischen Hinderung der Methylgruppen außerdem aus der Ebene der Carboxylatgruppen heraus (Abbildung S1 und S2, SI).
Die PXRD-Muster von Methyl-funktionalisiertem DMOF-X stimmen mit denen der Stammverbindung DMOF überein, was auf ihre isostrukturellen Gerüste hinweist (Abbildung S3, SI). Die 1H-NMR-Spektren der Lösung (Abbildung S5–S8, SI) von zersetztem DMOF und Methyl-funktionalisiertem DMOF-X bestätigten das erwartete molare 2:1-Verhältnis von BDC/BDC-X zu DABCO-Linker gemäß der Formel von [Ni2(BDC/BDC-X)2DABCO], was mit den Ergebnissen der Elementaranalyse übereinstimmt (siehe Abschnitt S3, SI). Im Vergleich zu DMOF wurde bei der REM-Analyse (Abbildung S9, SI) ein Trend zu einer stufenweisen Verringerung der Partikelgröße mit zunehmender Methylierung zu DMOF-TM beobachtet, was auf eine – mit zunehmender Anzahl von Methylgruppen – verringerte Wachstumsrate relativ zur Keimbildung zurückzuführen ist. N2- und Ar-Sorption bei 77 bzw. 87 K (Abbildung S11 und S12, SI) zeigen eine Abnahme der Brunauer-Emmett-Teller(BET)-Oberfläche und des Porenvolumens von DMOF und DMOF-X mit zunehmender Anzahl von Methylgruppen (Tabelle 1), die die Poren füllen und die zugängliche Oberfläche begrenzen.
Material |
BET-Oberfläche[a] (aus N2/Ar) [m2 g−1] |
Gesamtporenvolumen[b] (aus N2/Ar) [cm3 g−1] |
Porengröße[c] [Å] |
SO2-Aufnahme (293 K) [mmol g−1] bei: |
SO2/CO2-Selektivität[d] bei SO2/CO2-Verhältnis: |
||||
|---|---|---|---|---|---|---|---|---|---|
|
|
|
|
0,01 bar |
0,1 bar |
0,97 bar |
0,01 |
0,1 |
0,5 |
DMOF37 |
205039/– |
0,8039/– |
7,5, 5,6×6,9[37][e] |
– |
– |
9,97 (298)17 |
– |
– |
– |
DMOF |
1956/1843 |
0,76/0,67 |
ca. 6–8 |
0,25 |
7,21 |
13,09 |
18 |
36 |
92 |
DMOF-M |
1557/1586 |
0,63/0,59 |
ca. 6–8 |
0,46 |
6,40 |
12,15 |
27 |
38 |
81 |
DMOF-DM |
1343/1281 |
0,52/0,56 |
ca. 6–8 |
1,00 |
5,70 |
10,40 |
50 |
40 |
31 |
DMOF-TM |
900/1079 |
0,43/0,42 |
ca. 5–7 |
3,79 |
6,43 |
9,68 |
134 |
169 |
253 |
DMOF-TM39 |
89439/– |
0,3939/– |
4,5[39][e] |
– |
– |
ca. 4,9 (298)25 |
– |
– |
– |
- [a] Erhalten aus fünf Adsorptionspunkten im Druckbereich 0,001<p p0−1<0,05. [b] Bei p p0−1=0,9. [c] Porenweiten aus Porengrößenverteilung, gemessen durch Ar-Sorption bei 87 K. [d] Siehe Abschnitt S5.2 der SI für die CO2-Sorptionsdaten. [e] Aus Röntgenstrukturanalyse.
Die SO2-Sorptionsisotherme von DMOF zeigt eine leichte S-Form (relativ geringe SO2-Affinität, Abbildung 2 b), wobei die steile Aufnahme bei 0,04 bar einsetzt (Abbildung 2 b). Die SO2-Aufnahme von DMOF-X bei 293 K setzt mit zunehmender Anzahl der Methylgruppen bei immer niedrigerem Druck ein (Abbildung 2 b). Bei 0,01 bar wurde die SO2-Aufnahme von DMOF mit 0,25 mmol g−1 angegeben, während DMOF-M, DMOF-DM und DMOF-TM bereits eine erhöhte Aufnahme von 0,46, 1,00 und 3,79 mmol g−1 zeigten (Tabelle 1, Abbildung 2 b). Insbesondere die SO2-Aufnahme von DMOF-TM (3,79 mmol g−1) bei 0,01 bar übertrifft die meisten der aktuellen Spitzen-MOFs (Abbildung S13 und Tabelle S6, SI), wie Mg-MOF-74 (3,03 mmol g−1), SIFSIX-1-Cu (3,43 mmol g−1), SIFSIX-3-M (2,43 und 1,68 mmol g−1 für M=Ni und Zn) und NH2-MIL-125(Ti) (3,0 mmol g−1) und ist nur geringfügig niedriger als für SIFSIX-2-Cu-i (4,16 mmol g−1)31, 40 und MIL-160 (4,2 mmol g−1).31 Die beiden Letztgenannten weisen polare Gruppen (SiF62− bzw. einen Furanring) zusammen mit optimalen Mikroporenbreiten von ca. 5 Å auf (siehe unten). Als der Druck auf 0,1 bar erhöht wurde, stieg die SO2-Aufnahme von DMOF-TM schnell auf 6,43 mmol g−1 an, was ca. 66 % der SO2-Aufnahme ausmachte (9,68 mmol g−1 bei 0,97 bar). Die beobachtete hohe SO2-Aufnahme von DMOF-TM bei niedrigem Druck (<0,1 bar) erfüllt eine Voraussetzung für mögliche adsorptive Rauchgas-Entschwefelungsprozesse. Die SO2-Aufnahme bei ca. 1 bar zeigt einen linearen Zusammenhang mit der BET-Oberfläche und dem Porenvolumen (Abbildung 3). Die SO2-Kapazität bei 0,97 bar nahm, wie erwartet, mit zunehmender Dichte der Methylgruppen im DMOF ab, was auf die Verringerung des Porenvolumens und der BET-Oberfläche zurückgeführt werden kann (Tabelle 1 und Abbildung 3).
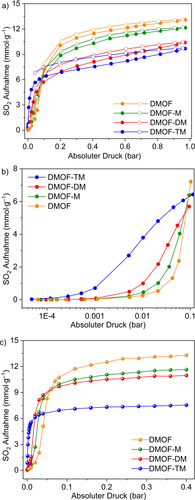
a) SO2-Sorptionsisothermen von DMOF und DMOF-X bei 293 K zwischen 0 und 0,97 bar.; b) Die vergrößerte SO2-Adsorption bei Niederdruck von 0–0,1 bar zur besseren Verdeutlichung des Beginns der steilen Aufnahme; c) Monte-Carlo-simulierte Isothermen der SO2-Adsorption an DMOF und DMOF-X zwischen 0 und 0,4 bar (Niederdruck) und 293 K.
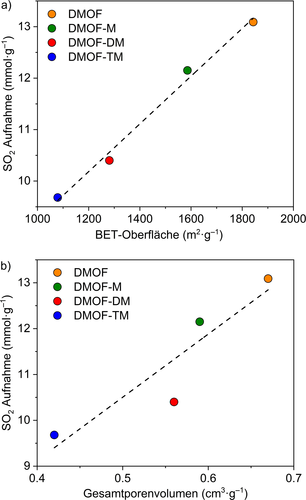
SO2-Aufnahme (0,97 bar, 293 K) vs. a) BET-Oberfläche und b) Gesamtporenvolumen (beide bestimmt durch Ar-Adsorption bei 87 K). Die gestrichelten Trendlinien dienen der Orientierung.
Die SO2-Adsorptionsisothermen bei 273 und 293 K wurden verwendet, um die isostere Enthalpie der SO2-Adsorption (−ΔHads) durch Virialanalyse zu bestimmen (Abbildung S14–S17, SI).41 Die −ΔHads-Werte der Methyl-funktionalisierten DMOFs waren deutlich höher als die der Stammverbindung DMOF und stiegen mit der Anzahl der Methylgruppen an (Abbildung 4). Des Weiteren folgen die −ΔHads-Werte der Aufnahme bei niedrigem Druck (<0,05 bar). Grand-Canonical-Monte-Carlo(GCMC)-Simulationen für eine Reihe von kleinporigen MOFs haben eine gute Korrelation der SO2-Aufnahme bei reduzierten Drücken (0,05 bar) und der Adsorptionswärme gezeigt.42

Isostere Enthalpie der Adsorption von SO2 an DMOF- und DMOF-X-Materialien aus der Anpassung der Adsorptionsisothermen von SO2 bei 273 und 293 K durch Virialanalyse (Abbildung S14–S17, SI).
Bei den niedrigen Drücken von 0,01 bar und 0,1 bar ist die Aufnahme in den DMOFs eindeutig unabhängig von der Gesamtoberfläche oder dem Porenvolumen (Abbildung 2 b). Wird stattdessen die SO2-Aufnahme bei diesen Drücken auf die Oberfläche normiert, erhält man die oberflächenspezifische SO2-Aufnahme, die gegen den begrenzenden Porendurchmesser (BPD) aufgetragen werden kann (Abbildung 5). Der BPD ist der kleinste Durchmesser einer Pore, eines Kanals oder einer Porenöffnung in einem Gerüst. Das Maximum der oberflächenspezifischen SO2-Aufnahme bei niedrigem Druck für DMOF-TM bei seinem BPD von ca. 4,5 Å weist auf diesen Wert als optimalen Porendurchmesser hin. Der Wert von ca. 4 Å stimmt mit dem kinetischen Durchmesser von SO2 (4,1 Å) überein.43 In einer Pore mit einer Breite von ca. 4 Å kann das SO2-Molekül mehrere dispersive Wechselwirkungen mit der Oberfläche eingehen. Offensichtlich ist es für Adsorber-Strukturen von Vorteil, Connolly-Oberflächen im Abstand der Länge des adsorbierten Moleküls aufzuweisen, das dann an mehreren Punkten mit der zugänglichen Oberfläche wechselwirken kann.44 Die Connolly-Oberfläche ist die dem Adsorbat zugängliche Oberfläche.
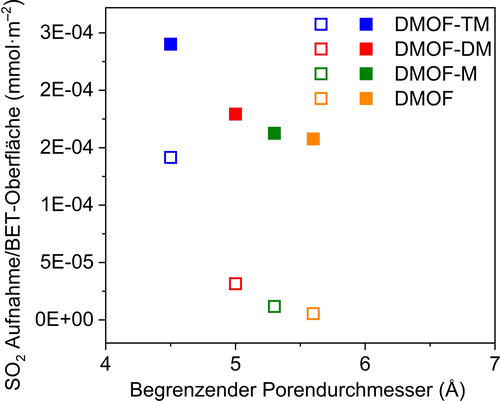
Oberflächenspezifische SO2-Aufnahme bei 0,01 bar (offene Symbole) und 0,1 bar (geschlossene Symbole; 293 K), d. h. die Aufnahme bei diesem Druck geteilt durch die BET-Oberfläche gegen den begrenzenden Porendurchmesser (BPD). Der BPD von DMOF-M und DMOF-DM wurde aus deren DFT-optimierten Strukturen bestimmt (siehe Abschnitt S8.2, Abbildung S43, SI).
Monte-Carlo-Simulationen der SO2-Adsorption bei 0–0,4 bar und 293 K wurden an DMOF und DMOF-X unter Verwendung des Programms Cassandra mit Standard-UFF/UFF4MOF-Parametern durchgeführt.45 Durch die simulierten Adsorptionsisothermen wurde der Trend der erhöhten SO2-Affinität von Methyl-funktionalisiertem DMOF-X mit zunehmender Dichte der Methylgruppen in den Simulationen gut reproduziert (Abbildung 2 c), obwohl die simulierten Isothermen die Aufnahme leicht überschätzten, am meisten für DMOF-DM (Abbildung S48, SI). Unterschiede zum Experiment entstehen durch die Vernachlässigung von Struktur-Zersetzung und möglicher Struktur-Flexibilität in den Simulationen (siehe Details zur Berechnung in SI-Abschnitt S8.2, S9 und Abbildungen S45, S46). Auch die Wahl des Kraftfeldes nimmt Einfluss auf die Simulationsergebnisse (Abbildung S47 dokumentiert den Einfluss verschiedener Kraftfelder auf die simulierte Adsorptionsisotherme von DMOF-TM). Eine individuelle Parametrisierung der Wirt-Gast-Wechselwirkungen kann daher zu einer weiteren Verbesserung der Simulationsdaten beitragen.
Das unterschiedliche SO2-Adsorptionsverhalten von DMOF und DMOF-TM wird durch Simulationsschnappschüsse bei verschiedenen Partialdrücken (Abbildung 6) und durch einen Film (erstellt mit dem Programm iRASPA)46 demonstriert, der die sukzessive Füllung mit steigendem Druck von 0 bis 0,4 bar (40 kPa) zeigt (Datei DMOF2.mp4 in SI). Bei DMOF-TM ist zu beachten, dass sich SO2 bereits bei sehr niedrigen Drücken bevorzugt in der Nähe der Methylgruppen der BDC-TM-Linker befindet, was auf günstige Methyl-SO2-Wechselwirkungen hinweist (siehe unten). Die Porenfüllung wird durch SO2-SO2-Dipol-Dipol-Wechselwirkungen zwischen 0,04 und 0,4 bar weiter verstärkt. Allerdings ist die SO2-Verteilung in DMOF im gleichen Niederdruckbereich (0,01–0,04 bar, Abbildung 6 d,e) spärlich. Die DMOF-SO2-Wechselwirkungen sind schwächer (siehe unten), und die Adsorption wird hauptsächlich durch SO2-SO2-Dipol-Dipol-Wechselwirkungen ausgelöst, bei denen SO2-Moleküle bevorzugt mit bereits adsorbierten SO2-Molekülen wechselwirken (siehe unten). Die Bildung von SO2-Clustern füllt schließlich die Poren bei 0,4 bar.
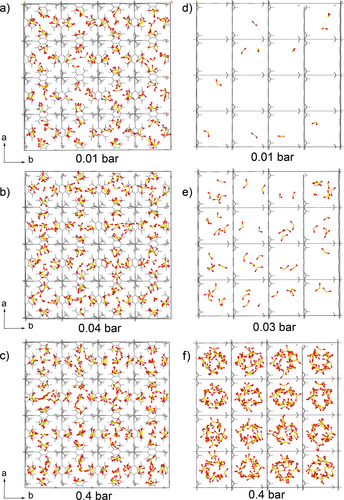
Monte-Carlo-Simulation der SO2-Beladung mit Moment-Aufnahmen bei 0,01, 0,03 bzw. 0,04 und 0,4 bar für DMOF-TM (a–c) und DMOF (d–f). Siehe Abbildung S50, SI für ein vergrößertes Bild und die Filmdatei DMOF2.mp4 für die vollständige Sequenz.
Die Einkomponenten-CO2-, -N2- und -CH4-Adsorptionsisothermen für DMOF und DMOF-X wurden bei 293 K gemessen (Abbildung S23, SI). Das gleiche Attribut aus der zunehmenden Dichte der Methylgruppen wurde auch für die erhöhte Niederdruck-CO2- und -CH4-Adsorption beobachtet, aber nicht für die N2-Adsorption (Abbildung S23 und Tabelle S2, SI). Allerdings war der Anstieg der Niederdruck-SO2-Adsorption mit der Zunahme der Methyldichte viel steiler als der von CO2 und CH4, was wahrscheinlich auf die hohe Polarisierbarkeit (47,7×10−25 cm3) und das hohe Dipolmoment (1,62 D) von SO2 zurückzuführen ist.47 Bei einem Druck von 0,97 bar stieg die Aufnahme von CO2 und CH4 mit der Methylgruppendichte für DMOF-X (Tabelle S2, SI), aber die absoluten spezifischen Mengen von CO2 und CH4 waren im Vergleich zur SO2-Aufnahme immer noch sehr viel geringer. Der Unterschied in der Gasaufnahme, insbesondere bei niedrigem Druck, zeigt das Potential von DMOF-X für die selektive SO2-Adsorption aus Rauchgasen.
Um die Selektivität von SO2 gegenüber CO2, CH4 und N2 zu bewerten, wurden Berechnungen mithilfe der Theorie der ideal adsorbierten Lösung (IAST, Ideal Adsorbed Solution Theory) für binäre Gasgemische in Abhängigkeit von variablen molaren SO2-Anteilen (von 0,01 bis 0,5) bei 1 bar und 293 K durchgeführt. In Anbetracht der im Rauchgas vorhandenen SO2-Spurenmenge ist eine hohe SO2-Selektivität gegenüber diesen anderen Gasen für einen realistischen adsorptiven Gas-Entschwefelungsprozess erforderlich. Bei einem molaren SO2/CO2-Verhältnis von 10:90 betrug die Selektivität von DMOF 35, während DMOF-M, -DM und -TM eine erhöhte Selektivität von 38, 40 und 169 aufwiesen (Abbildung 7 und Tabelle S6, SI). Nach unserem Kenntnisstand ist der SO2/CO2-Selektivitätswert für DMOF-TM der höchsten Wert von allen bisher dazu berichteten MOFs (Tabelle S6, SI). Gleichzeitig besitzt DMOF-TM auch eine hohe SO2/CH4- und SO2/N2-Selektivität von 725 bzw. 1141, wenn das SO2/CH4- bzw. SO2/N2-Verhältnis 10:90 beträgt (Abbildung S24–S25, SI).
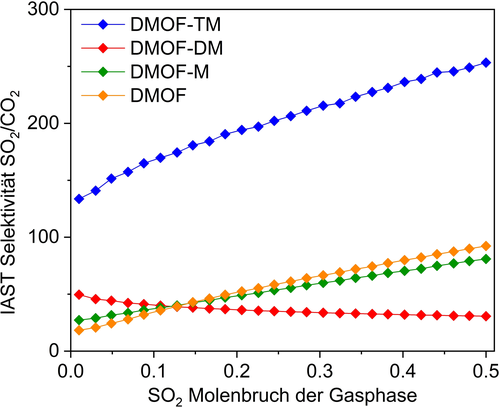
IAST-Selektivität von SO2/CO2 für die DMOF-X-Serie als Funktion der SO2-Molenbrüche (0,1–0,5) bei 1 bar und 293 K.
Die vorteilhaften Wechselwirkungen von Methyl-funktionalisierten DMOFs mit SO2 gegenüber der Stammverbindung DMOF wurden durch periodische dispersionskorrigierte DFT-Berechnungen (DFT-D) mit Quantum Espresso aufgeklärt.48 Mindestens drei Hauptbindungsstellen für SO2 sind innerhalb des Gerüsts vorhanden (Abbildung 8). Das adsorbierte SO2 wird von DMOF-TM wird innerhalb der Porenoberfläche hauptsächlich durch verstärkte (C)H(δ+)⋅⋅⋅(δ−)O(S)-Wechselwirkungen stabilisiert. Die optimierten H⋅⋅⋅O-Abstände von 2,59–2,97 Å zwischen Methylgruppen und SO2 sind deutlich geringer als die Summe der vdW-Radien von H- und O-Atomen (3,05 Å). Mehrere (C)H(δ+)⋅⋅⋅(δ−)O(S)-Wechselwirkungen zwischen DABCO und SO2 tragen zur Strukturstabilisierung mit H⋅⋅⋅O-Abständen von 2,46–2,97 Å bei (Bindungsstelle 2 und 3, Abbildung 8 b,c). Außerdem betragen die optimierten (Benzol)C⋅⋅⋅S-Abstände 3,21–3,38 Å, die kleiner sind als der analoge Wert (3,42 Å) in DMOF mit SO2. Dies deutet auf die erhöhte Stärke der Benzol(δ−)⋅⋅⋅(δ+)S-Wechselwirkungen hin, die wahrscheinlich durch den Einbau von elektronendonierenden Methylgruppen induziert werden. Die berechneten Bindungsenergien (−56,9 bis −61,0 kJ mol−1) von SO2 mit DMOF-TM waren signifikant höher als die mit DMOF (−31,3 bis −31,8 kJ mol−1) an den drei Hauptbindungsstellen für das erste SO2-Molekül (Abbildung S44, SI). Es ist zu beachten, dass thermische und Nullpunktenergie-Korrekturen in diesem Bild nicht enthalten sind. Um eine Abschätzung des Nullpunktenergie-Beitrags zu erhalten, haben wir Phonon-Berechnungen für SO2-gebundenes DMOF-TM durchgeführt (siehe SI-Abschnitt S8.2) und 8,8 kJ mol−1 erhalten. Mit diesem Wert als Referenz würden die ZPE-korrigierten Bindungsenergien im Bereich von ca. −48 bis −52 kJ mol−1 liegen. Dies steht in Übereinstimmung mit den höheren experimentellen <M->ΔHads-Werten von SO2 an DMOF-TM gegenüber DMOF (Abbildung 4). Anschließend untersuchten wir den Effekt einer erhöhten SO2-Beladung auf die Adsorption von DMOF-TM. DFT-D-Berechnungen zeigten, dass mindestens fünf SO2-Moleküle innerhalb des Kanals von DMOF-TM gefangen werden konnten (Abbildung S45, S46). Vier davon befanden sich primär in der Nähe der BDC-TM-Linker über nicht-kovalente Wirt-Gast-Wechselwirkungen, und das fünfte wurde im Zentrum des Kanals über SO2-SO2-Dipol-Dipol-Wechselwirkungen mit anderen, bereits vorhandenen SO2-Molekülen adsorbiert.
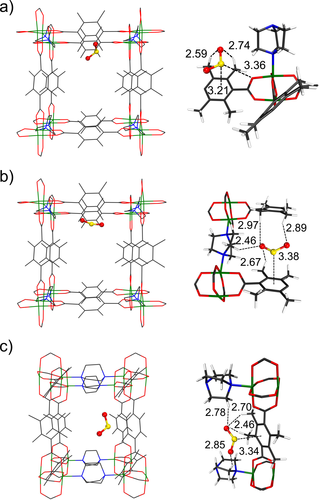
Periodische DFT-berechnete SO2-Bindungsstellen an optimiertem DMOF-TM (die Abstände sind in Å angegeben). Bindungsenergie an Stelle 1, a): −58,0 kJ mol−1; Stelle 2, b): −56,9 kJ mol−1; Stelle 3, c): −61,0 kJ mol−1. Die entsprechenden Stellen in DMOF sind in Abbildung S44, SI dargestellt. Die Berechnungsdetails sind in Abschnitt S8.2, SI angegeben. Farbcode: S gelb; O rot; N blau; Ni grün; C grau; H hellgrau. Wasserstoffatome auf den Gerüstbildern in der linken Spalte sind weggelassen.
Cluster-DFT-D-Berechnungen wurden mit Gaussian 1649 durchgeführt, um die Unterschiede in den Bindungswechselwirkungen zwischen SO2 und CO2 an DMOF und DMOF-TM zu vergleichen (Abbildung S41, S42, SI). Ähnlich wie bei den periodischen DFT-D-Ergebnissen ergaben die Strukturoptimierungen von DMOF-TM mit SO2 mehrere nicht-kovalente kooperative Wechselwirkungen (Abbildung S42, SI). Die optimierten H⋅⋅⋅O(S)-Abstände in DMOF-TM-Modellen mit SO2 (2,46–2,81 Å) sind kleiner als die mit CO2 (2,60–2,88 Å). Dies unterstützt die günstige Bindungswechselwirkung von DMOF-TM mit SO2 gegenüber CO2, in Übereinstimmung mit den höheren Bindungsenergien von DMOF-TM mit SO2 (Tabelle S3, SI). Zusätzlich haben wir Frequenzberechnungen für die Cluster-DFT-Modelle durchgeführt. Die resultierenden Adsorptionsenthalpien für DMOF- und DMOF-TM-Modelle sind in angemessener Übereinstimmung mit den experimentellen −ΔHads-Werten (Tabelle S3).
Es wurde versucht, SO2 in den Poren des DMOF-TM durch Pulver-XRD-Studien bei niedriger Temperatur (100 K) zu lokalisieren. Nach der näherungsweisen Strukturanalyse sind die SO2-Moleküle überwiegend im größten Hohlraum entlang der z-Achse im Bereich von x, y, z=0, 0, 0–0,3 und in der Nähe von zwei Methylgruppen desselben BDC-TM-Ligandenmoleküls bei etwa x, y, z=0, 0,38, 0,15 positioniert (Abschnitt S11, SI).
Das Potential zur SO2-Abscheidung aus anderen typischen Rauchgasen wurde durch Durchbruchexperimente und Simulationen mit dem ternären Gasgemisch N2/CO2/SO2 (84,9:15:0,1 v/v/v) bei 293 K und 1 bar untersucht. Aus den experimentellen Durchbruchkurven (Abbildung S38 und S39) war der sofortige Anstieg von N2 und CO2 in beiden Proben von DMOF und DMOF-TM deutlich zu erkennen. Die SO2-Retentionzeit unterscheidet sich jedoch signifikant; so kann SO2 in DMOF-TM für ca. 346 min g−1 zurückgehalten werden, aber die SO2-Retentionszeit in DMOF (Abbildung S38) betrug nur ca. 28 min g−1. Darüber hinaus wurde kein signifikanter Verlust der SO2-Retentionszeit im zweiten und dritten Lauf des regenerierten DMOF-TM (Abbildung 9 a) mit einer vergleichbaren SO2-Aufnahme über die drei Läufe (37 vs. 40 vs. 37 mg g−1 im ersten, zweiten und dritten Lauf) festgestellt. Bei DMOF (Abbildung 9 b) wurde jedoch die gesamte SO2-Beladung im zweiten Lauf deutlich von 5,5 auf 3 mg g−1 reduziert.
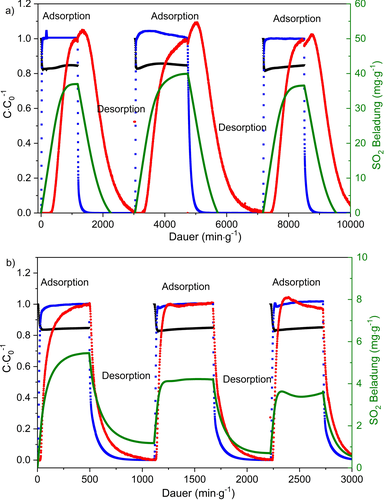
Drei Durchläufe der Adsorption und Desorption in zyklischen Durchbruchexperimenten einer a) DMOF-TM- und b) DMOF-Probe (rot: SO2; blau: CO2; schwarz: N2; grün: SO2-Beladungsaufnahme; aus einem ternären Gasgemisch aus N2/CO2/SO2 mit 84,9:15:0,1 v/v/v bei 293 K und 1 bar).
Die simulierten Durchbruchkurven wurden mit der Software 3P sim, Version 1.1.07 unter Verwendung der “Theorie der idealen adsorbierten Lösung” (IAST) mit Daten aus angeglichenen Dual-Site-Langmuir-SIPs-Isothermen berechnet.50 Es wurde nachgewiesen, dass das Ergebnis der Simulationen, die mit einer ähnlichen Software durchgeführt wurden, mit experimentellen Durchbruchstudien übereinstimmt, wenn die Trennung auf thermodynamischen und nicht auf kinetisch-sterischen Effekten beruht.51 Die Durchbruchsimulation mit der 3P-Software hat bereits gezeigt, dass sie eine zuverlässige Abschätzung der Durchbruchszeit für SO2 in Gasgemischen ermöglicht.14, 31 Aus den simulierten Durchbruchkurven ging hervor, dass die Retentionszeit von SO2 im Auslass durch die zunehmende Dichte der Methylgruppen im DMOF allmählich verlängert wurde, wobei 6, 14, 63 und 333 min g−1 für DMOF, DMOF-M, -DM bzw. -TM aufgezeichnet wurden (Abbildung S34–S37, SI). Beim DMOF-TM weist der sofortige Anstieg von N2 und CO2 im Auslass auf die vernachlässigbare N2- und CO2-Adsorption hin. Somit macht die hohe SO2/CO2- und SO2/N2-Trennleistung DMOF-TM vielversprechend für den adsorptiven Gas-Entschwefelungsprozess.
Um die Stabilität der DMOFs gegenüber SO2 zu untersuchen, wurden alle aktivierten Materialien 6 Stunden lang trockenem SO2 und 6 Stunden lang feuchtem SO2 ausgesetzt (bei 35 ppm SO2-Gehalt mit 75 % relativer Feuchte in der Luftatmosphäre, siehe Abschnitt S6, Abbildung S26, SI). Mit zunehmender Dichte der Methylgruppen verbesserte sich erwartungsgemäß allmählich die Strukturstabilität, wie aus der Auswertung der PXRD-Muster und der Porositätsmessungen durch N2-Sorption zu erkennen war. Die wenig veränderten PXRD-Muster aller Materialien nach trockener und feuchter SO2-Exposition deuten auf die Beibehaltung der Kristallinität ohne merkliche Phasenumwandlung oder Zersetzung hin (Abbildung S27, SI). Die BET-Oberfläche und das Porenvolumen von DMOF-DM (ca. 85 %) und DMOF-TM (ca. 90 %) blieben auch nach trockener und feuchter SO2-Adsorption gut erhalten (Abbildung S30–S32, SI). Es wurde berichtet, dass DMOF-TM eine gewisse Kristallinität beibehält, wobei die Oberfläche nach einer Exposition von 50 ppm SO2/85 % rel. Feuchte/1 Tag um 50 % abnimmt, aber nach einer Exposition von 100 ppm SO2/85 % rel. Feuchte/1 Tag einen vollständigen Verlust der Oberfläche aufweist.25 Bei DMOF (Abbildung S28, SI), das keine Methylgruppen aufweist, war die Porosität unter den gleichen SO2-Behandlungsbedingungen jedoch deutlich reduziert. Für DMOF-M (Abbildung S29, SI) gab es eine signifikante Verringerung der Porosität unter feuchter SO2-Exposition.
Die Regenerationsfähigkeit von DMOF-TM wurde weiter durch ein SO2-Adsorptionsexperiment im Recycling getestet. Unter Berücksichtigung der <M->ΔHads-Werte von DMOF-TM (ca. 50 kJ mol−1) haben wir DMOF-TM durch Anlegen von Vakuum (unter 10−3 mbar) bei Raumtemperatur für 1 Stunde regeneriert. Bemerkenswerterweise kann die SO2-Aufnahmekapazität von regeneriertem DMOF-TM für mindestens vier Durchläufe der SO2-Adsorption bei 0,97 bar und 293 K beibehalten werden (Abbildung S33, SI).
Das Vorhandensein von Schwingungsmoden von verbliebenem adsorbiertem SO2 in DMOF-TM unter Exposition des SO2-beladenen MOF (siehe Abschnitt S10, SI) an Luft (während 1–20 min) wurde durch FT-IR-Spektren untersucht. Zwei scharfe Banden bei 1331 und 1140 cm−1, die in ursprünglichem DMOF-TM nicht vorhanden sind und daher mit den Schwingungsmoden der SO2-Moleküle assoziiert werden, konnten in SO2-adsorbiertem DMOF-TM beobachtet werden (Abbildung S52). Die relative Intensität dieser Banden nahm allmählich ab, und die Banden waren nach 20 min fast verschwunden. Gleichzeitig wurden mehrere Schwingungsmoden, die dem DMOF-TM-Gerüst entsprechen, bei der SO2-Adsorption verändert (Abbildung S53): Es gibt 1) eine Blauverschiebung der Streckmoden von COO− (BDC-TM) von 1593 cm−1 und 1442 cm−1 auf 1597 cm−1 und 1444 cm−1; 2) eine Blauverschiebung der Phenyl-Biegemode von C=C (Benzol von BDC-TM) von 1539 cm−1 auf 1542 cm−1; 3) eine Blauverschiebung der Schwingungsmode von -CH3 (BDC-TM) von 3000 auf 3005 cm−1 sowie der von -CH2 (DABCO) von 2943 auf 2947 cm−1. Diese blauverschobenen Banden, die wir auf die Wechselwirkungen mit den adsorbierten SO2-Molekülen zurückführen, wurden wiederhergestellt, wenn die SO2-Banden nach 20 min verschwunden waren.
Fazit
Wir haben erfolgreich eine präsynthetische rationale Strategie zur Anpassung der Porenumgebung entwickelt, um Methyl-funktionalisierte DMOFs mit verbesserter Niederdruck-SO2-Adsorption und IAST-SO2/CO2-Selektivität zu erhalten. Die verbesserte Stabilität der Methyl-funktionalisierten DMOFs gegenüber dem hochkorrosiven SO2 wurde auf die erhöhte sterische Hinderung und Hydrophobie zurückgeführt, die durch die zunehmende Dichte der Methylgruppen induziert wird. Dank der einstellbaren Porengröße und -chemie zeigten DMOF-M und DMOF-DM eine hohe SO2-Kapazität (12,1 und 10,4 mmol g−1) bei 1 bar, während DMOF-TM eine hohe SO2-Aufnahme bei niedrigem Druck (3,79 mmol g−1 bei 0,01 bar) mit einer hohen IAST-SO2/CO2-Selektivität (169, für ein molares Verhältnis von SO2/CO2 bei 10/90) zeigte. Wie aus den Durchbruchsimulationen weiter hervorging, war die Retentionszeit von SO2 an DMOF-TM im Vergleich zu den anderen drei DMOFs am längsten. Die hochselektive SO2-Adsorption mit Methyl-funktionalisierten DMOFs, insbesondere mit DMOF-TM, wurde auf die mehrfachen moderaten nicht-kovalenten Wechselwirkungen des kleinporigen Methyl-funktionalisierten Gerüsts mit SO2-Molekülen zurückgeführt, wie durch DFT-Berechnungen bestätigt wurde. Die Methylierungs-Design-Strategie in unserer Arbeit sollte auch auf andere isostrukturelle Gerüste für hocheffiziente Gassorption und -trennung anwendbar sein. Auch die erwartete Rotationsfreiheit des BDC-TM-Liganden in DMOF-TM bei Raumtemperatur könnte ein Faktor sein, der die hohe Affinität zu SO2 erhöht, da die Methylgruppen einen doppelten schwachen Kontakt mit “brückenbildenden” SO2-Molekülen gewährleisten könnten.
Acknowledgements
S.H. Xing erhielt eine Förderung durch das Hoffmann Institute of Advanced Materials (HIAM), Shenzhen Polytechnic. Die Arbeit wurde von der Deutschen Forschungsgemeinschaft (DFG) unterstützt -396890929/ GRK 2482. Wir danken Alex Spieß, Dr. Alexa Schmitz, Daniel Komisarek, Christian Jansen und Dr. Vera Vasylyeva-Shor an der Heinrich-Heine-Universität Düsseldorf für Hilfe und Diskussionen. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




