Supramolekulare Bindungstaschen in [n]Cyclo-2,7-pyrenylenen
In memoriam Professor François Diederich
Abstract
Eine Reihe gespannter aromatischer Makrozyklen basierend auf [n]Cyclo-2,7-(4,5,9,10-tetrahydro)pyrenylenen wurde an der K-Region der Pyreneinheit mit Ethylenglykol-Gruppen funktionalisiert, um im Innenraum des Makrozyklus eine definierte Bindungstasche zu formen. Diese ist für den fünfgliedrigen Makrozyklus besonders ausgeprägt, was zu einer Bindungskonstante von 8.0×104 m−1 zwischen dem Ether-dekorierten [5]Cyclo-2,7-pyrenylen und einem komplementären Kronenether-Kation-Komplex führt. Die Ether-dekorierten [n]Cyclopyrenylene sowie einer der Wirt-Gast-Komplexe wurden durch Kristallstrukturanalyse charakterisiert. In Kombination mit computergestützten Berechnungsmethoden wurden die strukturellen und thermodynamischen Hintergründe für die besonders starken nicht-kovalenten Bindungseigenschaften erklärt. Die hier vorgestellte Strategie zur Formung von Bindungstaschen erschließt die Stoffklasse der Cycloparaphenylene als eine attraktive supramolekulare Wirt-Familie, die größenunabhängige Ausleseparameter und Bindungseigenschaften über Fulleren-Gäste hinaus zeigt.
Gespannte aromatische Makrozyklen zeigen im Vergleich zu deren linearen Analoga verbesserte Eigenschaften im Hinblick auf Formstabiltät, Löslichkeit und der Fähigkeit, Gastmoleküle zu binden.1-3 Cycloparaphenylene (CPPs) sind aufgrund ihrer größenabhängigen photophysikalischen und elektronischen Eigenschaften von zunehmendem Interesse.4-7 Infolgedessen wurden verschiedene Bottom-up-Strategien für die Synthese von CPPs oder deren Derivaten mit Hetero- und polycyclischen Aromaten entwickelt.8-12 Die Einbindung solcher Fragmente ermöglicht Untersuchungen neuer Funktionalitäten und optoelektronischer Eigenschaften dieser makrozyklischen Substanzklasse.13-17 Zudem konnten durch diese methodischen Arbeiten neue geometrische Formen vom Makrozyklus bis hin zum molekularen Käfig erschlossen werden.18-21 Während poröse molekulare Käfige intrinsisch ein Gastbindungsverhalten aufweisen, sind CPPs und verwandte gespannte Kohlenstoffmakrozyklen nur moderate supramolekulare Wirte, die sich meist auf die Bindung von Fulleren-Gästen beschränken.22-27 Durch eine Funktionalisierung des zyklischen Grundgerüsts wird eine räumliche Begrenzung des inneren molekularen Hohlraums erzeugt, die diese CPP-Makrozyklen in eine relevante Klasse supramolekularer Wirte verwandelt.
Im Hinblick auf Formstablilität und der größenabhängigen UV/Vis-Absorption und Emission zeigen Kohlenstoffnanogürtel herausstechende und einzigartige Eigenschaften im Vergleich zu anderen supramolekularen Wirtstrukturen, wie Calix[n]arenen, Resorcin[n]arenen und Cucurbit[n]urilen.28-31 Verbesserte Gastbindungseigenschaften dieser intrinsisch porösen und formstabilen Moleküle sollten zu einer höheren Verwertbarkeit in den verschiedenen Forschungsfeldern führen.32, 33
Wir berichten nun über eine Reihe hochfunktionalisierter [n]Cyclo-2,7-(4,5,9,10-tetrahydro)pyrenylene (CPYs) als supramolekulare Wirte mit definierten Bindungstaschen. Durch die vielseitige Entwicklung der Chemie am Pyren-Gerüst und die berichtete Synthese des [4]Cyclo-2,7-pyrenylens von Yamago und Mitarbeitern (Abbildung 1, oben) erwies sich der Aufbau eines gespannten Wirt-Makrozyklus aus Pyren als aussichtsreicher Startpunkt in diesem Arbeitsfeld.34, 35 Die molekulare Form der Pyren-Einheit führt zu einer π-konjugierten, konkaven inneren Wirt-Oberfläche, die ein zugängliches Hohlraumvolumen für Wirt-Gast-Wechselwirkungen schafft.
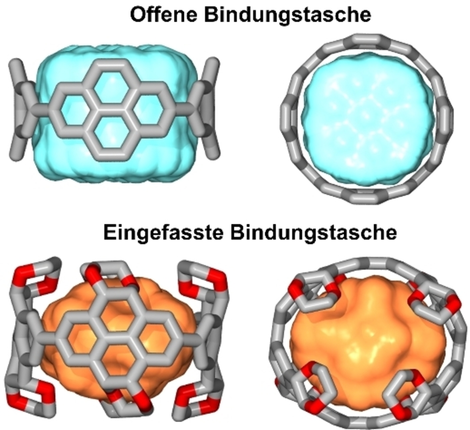
Vergleich der zugänglichen Bindungstaschen eines unfunktionalisierten [n]Cyclo-2,7-pyrenylens (CPY; oben) und eines hochfunktionalisierten [n]Cyclo-2,7-(4,5,9,10-tetrahydro)pyrenylens (unten; nicht alle Ethylenglykol-Gruppen sind zur besseren Lesbarkeit dargestellt; n=4).
Die K-Region des Pyrens wurde durch eine Ru-katalysierte Oxidation symmetrisch bifunktionalisiert, um Pyren-4,5,9,10-tetraon (5) zu erhalten.36 Der Aufbau des Wandfragments 4 für den Makrozyklus erfolgte durch eine säurekatalysierte Kondensation von 5 mit Ethylenglykol (Abbildung 2 a).37, 38 Wir entschieden uns für die regioselektive Ir-katalysierte C-H-Borylierung von 4, um den reaktiven Baustein 3 effizient herzustellen.39
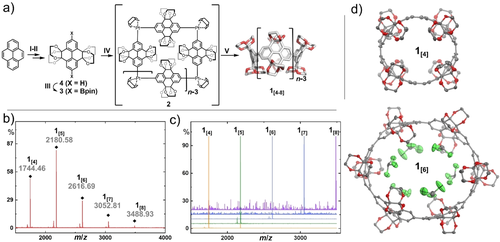
a) Synthese von 1[4–8] ausgehend von Pyren. Reagenzien und Bedingungen: I) RuCl3, NaIO4, CH3CN/CH2Cl2/H2O, 0 °C, 30 min, dann 25 °C, 2 h; II) Ethylenglykol, Camphersulfonsäure, MeOH, 120 °C, 24 h; III) 4,4′-Di-tert-butyl-2,2′-bipyridin, [Ir(OMe)(COD)]2, Bis(pinakolato)dibor, 1,4-Dioxan, 120 °C, 18 h; IV) [PtCl2(COD)], CsF, CH2Cl2, 45 °C, 24 h; V) PPh3, 1,2-Dichlorbenzol, 180 °C (Mikrowelle), 1 min. MALDI-TOF-Massenspektren b) des gefilterten Rohproduktes aus Schritt V und c) der isolierten Makrozyklen 1[4–8]. d) Einkristall-Röntgenstrukturen von 1[4] und 1[6], H-Atome und Lösungsmittelmoleküle (außer der innerhalb der Bindungstasche) wurden zur besseren Lesbarkeit entfernt; thermische Ellipsoide auf 50 % Wahrscheinlichkeitsniveau bei 100 K.77 COD=Cycloocta-1,5-dien.
Die nachfolgende Transmetallierung mit Dichlor(1,5-cyclooctadien)platin(II) gab Zugang zur makrozyklischen Vorstufe 2.11, 40, 41 Diese metallorganische Vorstufe konnte in vier Reaktionsschritten im Grammmaßstab ausgehend von Pyren ohne chromatographische Aufreinigung hergestellt werden. Im nächsten Schritt wurde eine reduktive Eliminierung durch Zugabe von Triphenylphosphin induziert. Die massenspektrometrische MALDI-TOF-Analyse ergab für das Rohprodukt eine Mischung aus fünf verschiedenen Ringgrößen 1[4–8] (Abbildung 2 b). Die verschieden großen, zyklischen Oligomere wurden durch Recycling-Gelpermeationschromatographie (GPC) erfolgreich aufgetrennt. Die Bildung verschiedener Ringgrößen ist ein bekanntes Phänomen, über das bereits in mehreren Beispielen an einer Pt-vermittelten Makrozyklisierung berichtet wurde.42-46 Auch wenn der Grund dieses variablen Größeneffekts noch nicht vollständig aufgeklärt wurde, profitiert unsere Studie vom Erlangen einer systematischen Reihe von Wirtmolekülen mit unterschiedlicher Größe durch eine Eintopfreaktion. In den Analysen des Pt-haltigen makrozyklischen Vorläufers konnten wir ausschließlich die Masse des tetrameren Moleküls 2 durch MALDI-TOF-Massenspektrometrie beobachten (siehe Abbildung S21 in den Hintergrundinformationen). Die Bildung anderer Pt-Ringgrößen, die mittels Massenspektrometrie nicht nachgewiesen werden konnten, erscheint in Bezug auf Literaturberichte trotzdem plausibel.42-46 Neben der Bildung verschieden großer Pt-Makrozyklen kann das im Reaktionsgemisch vorliegende Triphenylphosphin zur Bildung von Pt(PPh3)4−m führen. Diese reaktiven Komplexe sind für ihre insertierenden Eigenschaften in spannungsaktivierte C-C-Einfachbindungen bekannt. Eine dynamische Insertion des aktiven Pt(PPh3)4−m in die C-C-Bindung zwischen den Pyrenylen-Einheiten und nachfolgender Ligandenaustausch zyklischer Fragmente stellt eine weitere Erklärung für die Entstehung verschiedener Ringgrößen in unserer Synthese dar.12, 47-49
Die 1H-NMR-Spektren der Makrozyklen 1[n] zeigen jeweils eine einzige Singulett-Resonanz im aromatischen Bereich der chemischen Verschiebung, was der Dnh-Symmetrie (n=4–8) zugeschrieben werden kann (Abbildung S8–S19).50 Aufgrund begrenzter Löslichkeit des Oktamers 1[8] war keine umfängliche Charakterisierung durch NMR-Spektroskopie dieses Derivats möglich, was die Grenzen der Zugänglichkeit im Bezug auf die Ringgröße in der vorliegenden Reihe 1[n] aufzeigt. Die Einkristall-Röntgenstrukturanalyse lieferte schließlich den eindeutigen Strukturnachweis für die Derivate 1[4–6].77 Kohlenstoffreiche CPP-verwandte Makrozyklen gehen oftmals eine dichte “Herringbone”-Packung im kristallinen Feststoff ein, bei der die intrinsische Porosität verringert wird (Abbildung S34 und S39 für eine detaillierte Analyse).33, 51, 52 Im Gegensatz dazu kristallisieren die Zyklen 1[4] und 1[6] in einer versetzt-gestapelten, röhrenartigen Packung. Dies geschieht vermutlich aufgrund des sterischen Anspruchs der Ethylenglykol-Gruppen, die eine Verzahnung der Moleküle im Festkörper verhindern. Geeignete Einkristalle zur röntgenkristallographischen Analyse von 1[5] konnten ausschließlich mit einem Gastmolekül erhalten werden. Die definierte röhrenförmige Stapelung dieser Struktur kann daher nicht mit dem Packungsverhalten der anderen Strukturen verglichen werden. Die Kristallstruktur von 1[6] zeigt gut aufgelöste Chloroform-Solvatmoleküle, die durch schwache Cl3C-H⋅⋅⋅OWirt-Wasserstoffbrücken (3,1–3,3 Å Schweratomabstand) und mehrere eindrucksvolle C-Cl⋅⋅⋅OWirt-Halogenbrücken (2,7–3,3 Å) im inter- und intramolekularen Hohlraum fixiert sind (Abbildung 2 c, für eine detaillierte Analyse des Wechselwirkungsnetzwerkes zwischen 1[6] und den Solvat-CHCl3 siehe Hintergrundinformationen, Abbildung S36–S38).
Die UV/Vis-Absorptionsspektren der Reihe 1[4–8] zeigen ähnliche Absorptionsmaxima λmax für alle Ringgrößen (Abbildung 3, Tabelle 1). Dies ist eine typische Eigenschaft der Substanzklasse und kann durch einen formal Laporte-verbotenen optischen HOMO-LUMO-Übergang erklärt werden.6, 53, 54 Ausnahmen dieses verbotenen Übergangs zeigen sich in rotverschobenen Schultern neben den Absorptionsmaxima (400–450 nm). Obwohl die gesamte Reihe 1[4–8] scheinbar höhere Stokes-Verschiebungen aufweist, müssen diese Schultern zur Berechnung der echten Stokes-Verschiebung einbezogen werden, die dadurch im Bereich von 28–45 nm (0,20-0,31 eV, Tabelle 1) liegt.
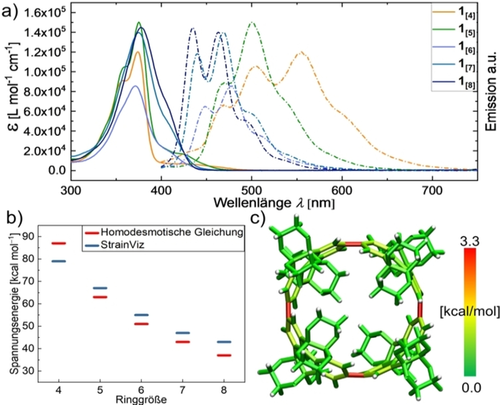
a) UV/Vis-Absorptions- (durchgehende Graphen) und Emissionsspektren (gestrichelte Graphen) von 1[4–8] (CHCl3, 25 °C). b) Berechnete molekulare Spannungsenergien aus dem homodesmotischen Modell und StrainViz (B3LYP/6-31G(d)). c) Graphische Darstellung der Spannungsverteilung für 1[4] durch StrainViz.
|
1[4] |
1[5] |
1[6] |
1[7] |
1[8] |
|---|---|---|---|---|---|
λmax [nm] |
374 |
375 |
371 |
375 |
378 |
λEmission [nm][a] |
468 |
468 |
448 |
440 |
435 |
Stokes-Verschiebung [eV] |
0,28 |
0,27 |
0,31 |
0,24 |
0,20 |
- [a] Anregung bei 375 nm.
Durch zeitabhängige Dichtefunktionaltheorie-Berechnungen (TD-DFT) konnten über die geringen Oszillatorstärken (f<0,2) die verbotenen HOMO-LUMO-Übergänge von 1[4–8] bestätigt werden (Abbildung S79–S83). Die einzigartigen photophysikalischen Eigenschaften der CPP-ähnlichen Makrozyklen können den konzentrischen Symmetrien der Strukturen in Kombination mit der gespannten gebogenen Geometrie der ansonsten planaren aromatischen Monomereinheiten zugesprochen werden. Wir berechneten die Spannungsenergien von 1[4–8] mit einem homodesmotischen Ansatz und zusätzlich mit dem Programm StrainViz (Abbildung 3 b,c).55, 56 Die Ergebnisse beider Ansätze folgen dem gleichen erwarteten Trend für 1[5–8], mit Ausnahme des kleinsten und gespanntesten Derivats 1[4], für das die homodesmotische Gleichung eine höhere Spannungsenergie als das Ergebnis aus der StrainViz-Analyse lieferte (Abbildung 3 b). Während die experimentelle Bestimmung solcher Spannungsenergien nicht möglich ist, erlauben die berechneten Werte einen guten qualitativen Vergleich innerhalb der hier vorgestellten Makrozyklenserie.
Der Vorteil von StrainViz liegt in der Visualisierung der Spannungsenergien an den betreffenden Bindungen mit gleichzeitiger Klassifizierung als Bindungs-, Winkel- und Torsionsspannungsenergien. Am stärksten manifestiert sich die Spannung in CPPs generell in der Torsionsspannung, weil ein idealer Biphenyl-Winkel von ca. 44° nicht für alle aromatischen Bausteine erfüllt werden kann (Abbildung S84–S88).57 Das zu 1[4] äquivalent große [8]CPP lässt eine gleichmäßig verteilte Torsionsspannung an allen acht Biphenyl-Einheiten erkennen. Im Vergleich dazu zeigt 1[4] jedoch eine Torsionsspannungsenergie, die auf den vier Bindungen lokalisiert ist, welche die Pyrenylen-Einheiten verknüpfen (gekennzeichnet durch die roten Bindungen, Abbildung 3 c).
Supramolekulare Bindungstaschen innerhalb der volumetrischen Zentren von 1[4–8] wurden durch die radial-konvergierenden Ethylenglykol-Reste im Bereich der Kavitätszugänge der Makrozyklen erschlossen. Ein entscheidender Parameter dieses Konzepts ist der Quotient des Öffnungsdurchmessers auf der Ebene der Ethylenglykol-Gruppen zum Kavitätsdurchmesser im Zentrum der Makrozyklen. Mit zunehmend schmalerer Öffnung wird die energetische Hürde, die Ethylengruppen zu überwinden, größer, und die Bindungstasche kann seltener durch einen Gast erreicht werden. Bei einer zu großen Öffnung verschwindet der Effekt eines umschlossenen Hohlraums im Inneren des Makrozyklus (siehe die Hintergrundinformationen, Abschnitt S7).58-60 Diese Betrachtungsweise wird durch den folgenden experimentellen Ansatz unterstützt. Mithilfe von 1H-NMR-Spektroskopie zeigen wir, dass 1[5] keine Komplexierung mit C60 eingeht (Abbildung S75), obwohl das strukturell ähnliche [10]CPP (mit der gleichen Anzahl von Phenyleneinheiten wie 1[5]) eine sehr starke Bindung mit C60-Fulleren eingeht (Ka=1010 m−1).61 Zusätzlich zu dem Quotienten der beiden Durchmesser spielt das Bindungstaschenvolumen eine weitere entscheidende Rolle. Dieses Volumen ist eine experimentell schwer zugängliche Größe und wurde daher für jede Ringgröße mit dem MS-Roll-Programm in X-Seed62 berechnet und dargestellt (Abbildung 4 und Abschnitt S7). Die Form und Größe einer Bindungstasche bestimmt deren Komplexierungsverhalten von Gastmolekülen einschlägig, wie bereits in der Literatur zu Wirt-Gast-Systemen berichtet wurde.63, 64 Während der Quotient des Öffnung-zu-Taschendurchmessers für [n]CPPs den Wert 1 annimmt, ist dieser für die Makrozyklen 1[4] und 1[5] mit 0,64 und 0,67 beachtlich kleiner (Tabelle S8). Um die erzeugten Bindungstaschen zu untersuchen, wurden zunächst Komplexierungsexperimente mit 1[5] durchgeführt. Makrozyklus 1[5] wurde ausgewählt, da der durchschnittliche Öffnungsdurchmesser an der Van-der-Waals-Oberfläche von 1[4] 3,65 Å beträgt. Dieser Durchmesser wird von uns als zu klein eingeschätzt, um von einem volumenfüllenden Gast passiert zu werden.
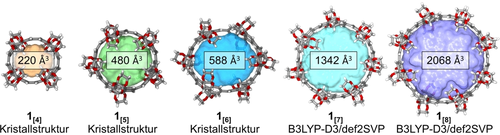
Einkristallröntgenstrukturen (1[4–6]) und DFT-optimierte Strukturen (1[7–8]) mit Innenraumvolumen, berechnet durch MS Roll in X-Seed.
Wirt-in-Wirt-Komplexe stellen einen interessanten Startpunkt in der Konstruktion von höheren Superstrukturen dar.65-67 Ein bekanntes Beispiel ist die Verkapselung von Kronenethern oder derer Stickstoff-haltiger Analoga innerhalb von Käfigmolekülen oder molekularen Kapseln.68-72 Wir wählten Kronenether als Gäste, weil diese eine flexible Konformation aufweisen, die für das Durchdringen der schmalen Öffnung der Makrozyklen benötigt wird, und weil sie in unterschiedlichen Größen für eine systematische Studie erhältlich sind. Zunächst wurden mehrere Metallkation-Kronenether-Komplexe für die Bindung in 1[5] unter Verfolgung mit UV/Vis-Absorptionsspektroskopie in CHCl3 bei 25 °C untersucht. Die Zugabe von 12-Krone-4⋅LiCl führte zu keiner Änderung in der Absorption (Abbildung S61). Hingegen war eine bathochrome Verschiebung in Kombination mit einer Verschmälerung der Absorptionsbande und der Ausbildung mehrerer isosbestischer Punkte bei der Zugabe von 15-Krone-5⋅Na(BF4) zu beobachten. Das neue Absorptionsmaximum λmax des Komplexes 1[5]⋅⋅⋅[15-Krone-5⋅Na(BF4)] ist im Vergleich zu 1[5] um 9 nm rotverschoben. Isotherme UV/Vis-Absorptionstitration durch Zugabe von bis zu 54 Äquivalenten 15-Krone-5⋅Na(BF4) und anschließende nicht-lineare Kurvenanpassung ergaben eine Assoziationskonstante Ka=8,0×104 m−1 (Abbildung 5 a,b, oben). Die perfekte Passform des Gastes in die Bindungstasche wurde durch DFT-Berechnungen bestätigt (Abbildung S54 und Tabelle S9). Nach bestem Wissen ist dies die stärkste supramolekulare Bindung für einen nicht-fullerenartigen Gast innerhalb eines CPP oder eines CPP-verwandten Makrozyklus.
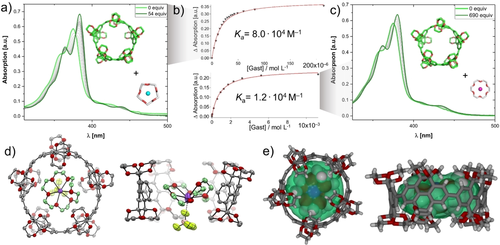
a) UV/Vis-Bindungstitration von 1[5] (c0=3,8 μm) durch Zugabe von 15-Krone-5⋅(NaBF4) bei 25 °C in CHCl3. b) Änderung der Absorptionsintensität in Bezug auf die Gastkonzentration und Kurvenanpassung an 1:1-Isothermen (durchgezeichnete Linie). c) UV/Vis-Bindungstitration von 1[5] (c0=3,8 μm) durch Zugabe von 18-Krone-6⋅K(BF4) bei 25 °C in CHCl3. d) Einkristall-Röntgenstruktur von 1[5]⋅⋅⋅[18-Krone-6⋅K(BF4)], H-Atom und Lösungsmittelmoleküle wurden zur besseren Lesbarkeit entfernt; thermische Ellipsoide auf 50 % Wahrscheinlichkeitsniveau bei 100 K, die rechte Struktur zeigt die Auswölbung der Konformation der 18-Krone-6.77 e) Draufsicht und Seitenansicht der Einkristall-Röntgenstruktur von 1[5]⋅⋅⋅[18-Krone-6⋅K(BF4)], bei der 1[5] als Stabmodell und 18-Krone-6⋅K+ als Van-der-Waals-Kugeln dargestellt sind; die grüne Oberfläche repräsentiert die Kontur des berechneten Innenraumvolumens.
Um weitere strukturelle Informationen zum Bindungsverhalten zu erhalten, wurden isotherme 1H-NMR-Bindungstitrationen durchgeführt. Aufgrund geringer Löslichkeit konnten die für NMR benötigten, höheren Konzentrationen im Vergleich zu den UV/Vis-Experimenten nicht erreicht werden. Dies zeigte sich in einer Signalverbreiterung und dem Ausfallen von Feststoff während der schrittweisen Zugabe von 15-Krone-5⋅Na(BF4) zu einer Lösung von 1[5] in CDCl3 (Abbildung S74). Um die Größenabhängigkeit des Bindungsverhaltens zu untersuchen, gingen wir zum nächstgrößeren Kronenether 18-Krone-6 und seinem K+-Komplex über. Die isotherme UV/Vis-Absorptionstitration nach Zugabe von 18-Krone-6⋅K(BF4) (Abbildung 5 c) ergab eine bathochrome Verschiebung des Maximums λmax um 5 nm, was wiederum mit Verschmälerung der Bande und dem Entstehen mehrerer isosbestischer Punkte einherging. Eine Kurvenanpassung der Titrationsdaten errechnete eine Assoziationskonstante von Ka=1,2×104 m−1 (Abbildung 5 b, unten). Im Vergleich zu der Bindung von 15-Krone-5⋅Na+ mit 1[5] kann dieser kaum geringere Ka-Wert durch den flexibleren Konformationsspielraum der Kronenether innerhalb der Bindungstasche erklärt werden. 18-Krone-6 kann sein Form an die starre Wirt-Tasche durch dihedrales Herausdrehen einer Ethylenglykol-Einheit anpassen. Diese Flexibilität der Konformation wurde in der Röntgenkristallstruktur des Komplex bestätigt (siehe unten). Im Gegensatz dazu zeigt der gleich große zugrundeliegende [10]CPP ohne einhüllende Bindungstasche eine signifikant geringere Assoziationskonstante von Ka=103 m−1 und Ka=24 m−1 für 15-Krone-5⋅Na(BF4) und 18-Krone-6⋅K(BF4) bei 25 °C in CHCl3 (Abbildung S70–S73). Um diese Bindungsreihe zu vervollständigen, wurde auch die Komplexierung des größeren Dibenzo-18-krone-6-ethers untersucht, der sogar für die Einbindung in 1[7] zu groß wäre. Keine Bindung konnte experimentell festgestellt werden (weder für 1[5] noch für 1[7], siehe Abbildung S59 und Abbildung S69).
Bindungsstudien zwischen dem Wirt 1[6] und verschiedenen Kronenethern ergaben keine starke Komplexierung mit 15-Krone-5⋅Na(BF4) (Ka=28 m−1) oder mit 18-Krone-6⋅K(BF4) (Ka zu gering, um experimentell gemessen zu werden, Abbildung S66–S68). Dieses Ergebnis zeigt den Effekt der Volumenzunahme der Bindungstasche um 23 % des Wirts 1[6] im Vergleich zu 1[5]. Wir schlussfolgern daraus, dass es für 1[6] deutlich größerer Gäste bedarf, um ein amplifiziertes Bindungsverhalten zu erzeugen. Außerdem konnte keine Bindung zwischen 1[4] mit dem kleinsten Kronenether 12-Krone-4⋅LiCl beobachtet werden, was mit der bereits erwähnten, zu geringen Öffnung erklärt werden kann, deren kinetische Überwindung vermutlich mehr Energie benötigt (Abbildung S56).
Einkristalle für die Röntgenstrukturanalyse mittels Synchrotronstrahlung des Komplexes 1[5]⋅⋅⋅[18-Krone-6⋅K(BF4)] konnten gezüchtet werden (Abbildung 5 d). Der kationische 18-Krone-6⋅K+-Komplex befindet sich im Zentrum der Bindungstasche von 1[5], und die Ethylenglykol-Gruppen von 1[5] umhüllen den Gast in Form einer sekundären Koordinationssphäre.72 18-Krone-6⋅K+ ist in einer ungewöhnlichen, nicht-planaren Konformation gebunden, in der eine der Ethylenglykol-Einheiten aus der Ebene gedreht ist. Der energetische Nachteil dieser verdrehten Konformation im Vergleich zu der ansonsten optimalen planaren Konformation wurde rechnerisch zu 2,0 kcal mol−1 bestimmt (DFT:B3LYP-D3/QZVP im Vakuum, Abbildung S45), was gut durch die supramolekulare Bindungsenthalpie kompensiert werden kann. Die Zentroidabstände der Phenyl-Untereinheiten von 1[5] und der C-Atome des Kronenethers weisen zehn kurze Kontakte auf (3,5–4,0 Å), die als C-H⋅⋅⋅π-Wechselwirkungen erkennbar sind (Abbildung S43). Es wurden mehrere weitere C-H⋅⋅⋅O-Wasserstoffbrücken zwischen den deutlich polarisierten C-H-Gruppen des Kronenethers als Wasserstoffbrückendonor und der Sauerstoffatome des Wirts 1[5] als Wasserstoffbrückenakzeptor identifiziert (Abbildung S45). Die Kristallstruktur weist eine röhrenförmige Packung von 1[5] auf, in der die Leerräume mit mit 18-Krone-6⋅K+ und dem BF4−-Anion gefüllt sind und die entstehenden Säulenstapel der Struktur hexagonale Kreispackungsmotive bilden (Abbildung S42).73, 74
Zusammenfassend wurde eine Serie von fünf [n]Cyclo-2,7-(4,5,9,10-tetrahydro)pyrenylenen 1[4–8] erfolgreich synthetisiert, die mit Ethylenglykol-Gruppen an der Randkante supramolekulare Bindungstaschen im Inneren der Makrozyklen ausbilden. Der einhüllende Effekt dieser Bindungstasche wurde durch eine signifikant schwächere Bindung von 15-Krone-5⋅Na(BF4) in [10]CPP oder 18-Krone-6⋅K(BF4) in [10]CPP demonstriert. Daher wird die verbesserte Bindungseigenschaft der einhüllenden Bindungstasche von 1[5] zugeschrieben. Die daraus resultierenden zusätzlichen Wasserstoffbrücken-Akzeptoren der dipolaren Ethylenglykol-Gruppen des Wirtes bilden ein kooperatives Netzwerk aus attraktiven Wechselwirkungen.75 Die gemessene Assoziationskonstante von 15-Krone-5⋅Na(BF4) in 1[5] ist die stärkste bisher gefundene Bindung eines nicht-fullerenartigen Gastes zu einem CPP-verwandten Makrozyklus. Dies zeigt das Potential des Ansatzes, um diese hoch-fluoreszierenden und formstabilen Makrozyklen als eine neue Klasse supramolekularer Wirte über die Fulleren-Gäste hinaus zu etablieren.61, 76
Acknowledgements
Wir danken André Dallmann für Unterstützung bei der NMR-Spektroskopie, Christian Feiler und Manfred Weiss für die Unterstützung am Beamline-Sektor MX14.2 des BESSY-II, Hanna Arndt für die Maßstabsvergrößerung der Zielmoleküle, Sebastian Pallasch für Vorschläge bei der Auswahl der Gastmoleküle, Josefine Sprachmann für wertvolle Kommentare zu diesem Manuskript, Beatrice Cula und Charlotte Stern (Northwestern) für ihre kristallographische Beratung und Oskar Knittelfelder für die HR-ESI-Massenspektrometrie. N.G. wurde durch ein Doktoranden-Stipendium des Fonds der Chemischen Industrie (FCI) gefördert, und O.D. dankt dem FCI für die Unterstützung durch ein Liebig-Stipendium. Wir danken Stefan Hecht für seine durchgehende Unterstützung. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




