Enzymatischer Amin-Acyl-Austausch in Peptiden auf Gold-Oberflächen†
Roberto Castangia
The School of Chemistry and MIB, The University of Manchester, 131 Princess Street, Manchester M1 7DN (Großbritannien)
Search for more papers by this authorDr. Martina Austeri
The School of Chemistry and MIB, The University of Manchester, 131 Princess Street, Manchester M1 7DN (Großbritannien)
Search for more papers by this authorCorresponding Author
Prof. Sabine L. Flitsch
The School of Chemistry and MIB, The University of Manchester, 131 Princess Street, Manchester M1 7DN (Großbritannien)
The School of Chemistry and MIB, The University of Manchester, 131 Princess Street, Manchester M1 7DN (Großbritannien)Search for more papers by this authorRoberto Castangia
The School of Chemistry and MIB, The University of Manchester, 131 Princess Street, Manchester M1 7DN (Großbritannien)
Search for more papers by this authorDr. Martina Austeri
The School of Chemistry and MIB, The University of Manchester, 131 Princess Street, Manchester M1 7DN (Großbritannien)
Search for more papers by this authorCorresponding Author
Prof. Sabine L. Flitsch
The School of Chemistry and MIB, The University of Manchester, 131 Princess Street, Manchester M1 7DN (Großbritannien)
The School of Chemistry and MIB, The University of Manchester, 131 Princess Street, Manchester M1 7DN (Großbritannien)Search for more papers by this authorDieses Projekt wurde durch EPSRC, die Europäische Union FP6&7, den Schweizerischen Nationalfonds (M.A.) und die Royal Society (Wolfson Merit award für S.L.F.) finanziell gefördert.
Graphical Abstract
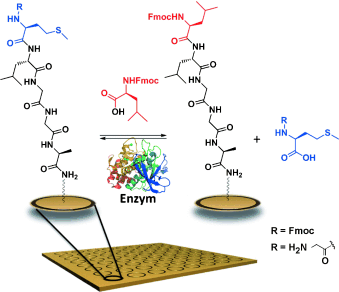
Reversibel, stereo- und chemoselektiv verläuft der von verschiedenen Proteasen wie Thermolysin oder Chymotrypsin katalysierte enzymatische Amin-Acyl-Austausch. Der Acyl-Austausch ermöglicht die Modifikation von Amin-funktionalisierten Oberflächen unter physiologischen Bedingungen und bietet einen alternativen Reaktionsmechanismus für natürliche posttranslationale Transpeptidierungen wie die Peptid-Spleißreaktionen im Proteasom.
Supporting Information
Detailed facts of importance to specialist readers are published as ”Supporting Information”. Such documents are peer-reviewed, but not copy-edited or typeset. They are made available as submitted by the authors.
| Filename | Description |
|---|---|
| ange_201205404_sm_miscellaneous_information.pdf1.1 MB | miscellaneous_information |
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1
- 1aP. Rota, P. Allevi, R. Colombo, M. L. Costa, M. Anastasia, Angew. Chem. 2010, 122, 1894–1897;
10.1002/ange.200906055 Google ScholarAngew. Chem. Int. Ed. 2010, 49, 1850–1853;
- 1bP. Rota, P. Allevi, I. S. Agnolin, R. Mattina, N. Papini, M. Anastasia, Org. Biomol. Chem. 2012, 10, 2885.
- 2L. Fornelli, A. W. Schmid, L. Grasso, H. Vogel, Y. O. Tsybin, Chem. Eur. J. 2011, 17, 486–497.
- 3K. Piotukh, B. Geltinger, N. Heinrich, F. Gerth, M. Beyermann, C. Freund, D. Schwarzer, J. Am. Chem. Soc. 2011, 133, 17536–17539.
- 4C. R. Berkers, A. de Jong, H. Ovaa, B. Rodenko, Int. J. Biochem. Cell Biol. 2009, 41, 66–71.
- 5
- 5aO. Torre, E. Busto, V. Gotor-Fernandez, V. Gotor, Adv. Synth. Catal. 2007, 349, 1481–1488;
- 5bP. O. Syrén, K. Hult, ChemCatChem 2011, 3, 853–860;
- 5cG. Cardillo, A. Gennari, L. Gentilucci, E. Mosconi, A. Tolomelli, S. Troisi, Tetrahedron: Asymmetry 2010, 21, 96–102.
- 6N. P. Awasthi, R. P. Singh, J. Oleo Sci. 2007, 56, 507–509.
- 7
- 7aA. Dalet, V. Stroobant, N. Vigneron, B. J. van den Eynde, Eur. J. Immunol. 2011, 41, 39;
- 7bJ. Liepe, M. Mishto, K. Textoris-Taube, K. Janek, C. Keller, P. Henklein, P. M. Kloetzel, A. Zaikin, PLoS Comput. Biol. 2010, 6, e 1000830;
- 7cA. Dalet, N. Vigneron, V. Stroobant, K. Hanada, B. J. Van den Eynde, J. Immunol. 2010, 184, 3016;
- 7dN. Vigneron, V. Stroobant, J. Chapiro, A. Ooms, G. Degiovanni, S. Morel, P. van der Bruggen, T. Boon, B. J. Van den Eynde, Science 2004, 304, 587.
- 8R. V. Ulijn, B. Baragana, P. J. Halling, S. L. Flitsch, J. Am. Chem. Soc. 2002, 124, 10988–10989.
- 9R. Haddoub, M. Dauner, F. A. Stefanowicz, V. Barattini, N. Laurent, S. L. Flitsch, Org. Biomol. Chem. 2009, 7, 665–670.
- 10
- 10aJ. C. Love, L. A. Estroff, J. K. Kriebel, R. G. Nuzzo, G. M. Whitesides, Chem. Rev. 2005, 105, 1103–1169;
- 10bB. T. Houseman, J. H. Huh, S. J. Kron, M. Mrksich, Nat. Biotechnol. 2002, 20, 270–274;
- 10cN. Laurent, J. Voglmeir, A. Wright, J. Blackburn, N. T. Pham, S. C. C. Wong, S. J. Gaskell, S. L. Flitsch, ChemBioChem 2008, 9, 883.
- 11
- 11aB. W. Matthews, Acc. Chem. Res. 1988, 21, 333–340;
- 11bH. Matsubara, Biochem. Biophys. Res. Commun. 1966, 24, 427–430;
- 11cH. Matsubara, R. Sasaki, A. Singer, T. H. Jukes, Arch. Biochem. Biophys. 1966, 115, 324–331.
- 12K. Inouye, J. Biochem. 1992, 112, 335–340.
- 13Typische experimentelle Vorschrift: Die Fmoc-geschützte Aminosäure 12 (40 mg mL−1) wurde in 100 mM Tris-Puffer (pH 7.5) mit 10 mM CaCl2 und 4 M NaCl dispergiert. Dann wurde Thermolysin (0.01 mg mL−1) zugesetzt. Die Mischung wurde auf die funktionalisierte Oberflächen mit den Peptiden 4–11 aufgetragen (0.5 μL pro Feld). Anschließend wurde 30 min bei 37 °C inkubiert, und die Reaktion wurde durch Waschen der Platte mit 0.1 % Ameisensäure in Wasser beendet. Die Analyse erfolgte durch MALDI-ToF-MS (Bruker Ultraflex II TOF/TOF) mit einer 55 mM 2,4,6-Trihydroxyacetophenon-Monohydrat(THAP)-Matrixlösung in Aceton. Um die Bildung von Kaliumaddukten zu verhindern, wurde die Matrixlösung mit 1 % einer 10 μM NaCl-Lösung in Wasser (Reinheitsgrad HPLC) versetzt. Spektren wurden in “reflectron positive mode” mit einem Stickstofflaser (337 nm) bei 40 % Abschwächung und einer 25-kV-Ionenquelle aufgenommen und mit der Flexanalysis Software (Bruker, USA) bei Standard-Integrationseinstellungen analysiert.
- 14R. L. Heinrikson, Methods Enzymol. 1977, 47, 175–189.
- 15N. Laurent, R. Haddoub, J. Voglmeir, S. C. C. Wong, S. J. Gaskell, S. L. Flitsch, ChemBioChem 2008, 9, 2592–2596.
- 16A. R. Hirst, B. Escuder, J. F. Miravet, D. K. Smith, Angew. Chem. 2008, 120, 8122–8139;
10.1002/ange.200800022 Google ScholarAngew. Chem. Int. Ed. 2008, 47, 8002–8018.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.