Mit N-heterocyclischem Gallylen stabilisierte niedervalente Ge2- und Ge4-Spezies†
Correction(s) for this article
-
Berichtigung: Mit N-heterocyclischem Gallylen stabilisierte niedervalente Ge2- und Ge4-Spezies
- Adinarayana Doddi,
- Christian Gemel,
- Manuela Winter,
- Roland A Fischer,
- Catharina Goedecke,
- Henry S. Rzepa,
- Gernot Frenking,
- Volume 125Issue 8Angewandte Chemie
- pages: 2202-2202
- First Published online: February 13, 2013
Adinarayana Doddi
Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Search for more papers by this authorDr. Christian Gemel
Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Search for more papers by this authorManuela Winter
Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Search for more papers by this authorCorresponding Author
Dr. Roland A Fischer
Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Roland A Fischer, Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Gernot Frenking, Fachbereich Chemie, Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg (Deutschland)
Search for more papers by this authorCatharina Goedecke
Fachbereich Chemie, Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg (Deutschland)
Search for more papers by this authorDr. Henry S. Rzepa
Department of Chemistry, Imperial College, London (Großbritannien)
Search for more papers by this authorCorresponding Author
Dr. Gernot Frenking
Fachbereich Chemie, Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg (Deutschland)
Roland A Fischer, Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Gernot Frenking, Fachbereich Chemie, Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg (Deutschland)
Search for more papers by this authorAdinarayana Doddi
Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Search for more papers by this authorDr. Christian Gemel
Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Search for more papers by this authorManuela Winter
Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Search for more papers by this authorCorresponding Author
Dr. Roland A Fischer
Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Roland A Fischer, Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Gernot Frenking, Fachbereich Chemie, Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg (Deutschland)
Search for more papers by this authorCatharina Goedecke
Fachbereich Chemie, Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg (Deutschland)
Search for more papers by this authorDr. Henry S. Rzepa
Department of Chemistry, Imperial College, London (Großbritannien)
Search for more papers by this authorCorresponding Author
Dr. Gernot Frenking
Fachbereich Chemie, Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg (Deutschland)
Roland A Fischer, Lehrstuhl für Anorganische Chemie II, Organometallics and Materials, Fakultät für Chemie und Biochemie, Ruhr-Universität Bochum, 44780 Bochum (Deutschland)
Gernot Frenking, Fachbereich Chemie, Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg (Deutschland)
Search for more papers by this authorFür die Unterstützung durch den Fonds der Chemischen Industrie wird gedankt.
Graphical Abstract
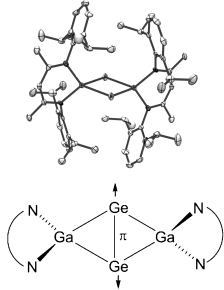
Viel π und kein σ! Im Ga2Ge2-Kern von Ge2[Ga(DPP)]2 liegt einer ausführlichen theroretischen Analyse zufolge zwischen den beiden Ge-Atomen keine σ-Bindung vor, eine transannulare π-Bindung hingegen schon (siehe Bild). Die Verbindung entsteht bei der Reduktion von (PCy)3⋅GeCl2 mit Ga(DDP)/KC8, die als ein weiteres Produkt auch Ge4[Ga(DPP)]2 mit einem Ge4-Tetraeder liefert. DDP = HC(CMeNC6H3-2,6-iPr2)2.
Supporting Information
As a service to our authors and readers, this journal provides supporting information supplied by the authors. Such materials are peer reviewed and may be re-organized for online delivery, but are not copy-edited or typeset. Technical support issues arising from supporting information (other than missing files) should be addressed to the authors.
| Filename | Description |
|---|---|
| ange_201204440_sm_miscellaneous_information.pdf8.1 MB | miscellaneous_information |
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1Y. Wang, Y. Xie, P. Wei, R. B. King, H. F. Schaefer, P. von R. Schleyer, G. H. Robinson, Science 2008, 321, 1069–1071.
- 2A. Sidiropoulos, C. Jones, A. Stasch, S. Klein, G. Frenking, Angew. Chem. 2009, 121, 9881–9884;
10.1002/ange.200905495 Google ScholarAngew. Chem. Int. Ed. 2009, 48, 9701–9704.
- 3Y. Wang, Y. Xie, P. Wei, R. B. King, H. F. Schaefer, P. von R. Schleyer, G. H. Robinson, J. Am. Chem. Soc. 2008, 130, 14970–14971.
- 4M. Y. Abraham, Y. Wang, Y. Xie, P. Wei, H. F. Schaefer, P. von R. Schleyer, G. H. Robinson, Chem. Eur. J. 2010, 16, 432–435.
- 5
- 5aY. Wang, G. H. Robinson, Dalton Trans. 2012, 41, 337–345;
- 5bY. Wang, G. H. Robinson, Chem. Commun. 2009, 5201–5213.
- 6J. L. Dutton, D. J. D. Wilson, Angew. Chem. 2012, 124, 1506–1509;
10.1002/ange.201107815 Google ScholarAngew. Chem. Int. Ed. 2012, 51, 1477–1480.
- 7M. Asay, C. Jones, M. Driess, Chem. Rev. 2011, 111, 354–396.
- 8N. J. Hardman, B. E. Eichler, P. P. Power, Chem. Commun. 2000, 1991–1992.
- 9G. Prabusankar, A. Kempter, C. Gemel, M. K. Schröter, R. A. Fischer, Angew. Chem. 2008, 120, 7344–7347;
10.1002/ange.200802470 Google ScholarAngew. Chem. Int. Ed. 2008, 47, 7234–7237.
- 10G. Prabusankar, C. Gemel, P. Parameswaran, C. Flener, G. Frenking, R. A. Fischer, Angew. Chem. 2009, 121, 5634–5637;
10.1002/ange.200902172 Google ScholarAngew. Chem. Int. Ed. 2009, 48, 5526–5529.
- 11
- 11aA. Schnepf, Eur. J. Inorg. Chem. 2008, 1007–1018;
- 11bA. Schnepf, Chem. Soc. Rev. 2007, 36, 745–758;
- 11cA. Schnepf, Coord. Chem. Rev. 2006, 250, 2758–2770.
- 12Alle Signale, die im 1H-NMR-Spektrum von 1 beobachtet wurden, sind zugeordnet, und es gibt keine Signale in der typischen Region der Ge-H-Gruppen (ca. 3.92 und 8.0 ppm), auch die IR- und Raman-Spektren zeigen keine Hinweise auf die Anwesenheit von terminalen Ge-H-Anteilen:
- 12aK. C. Thimer, S. M. I. Al-Rafia, M. J. Ferguson, R. McDonald, E. Rivard, Chem. Commun. 2009, 7119–7121;
- 12bS. L. Choong, W. D. Woodul, C. Schenk, A. Stasch, A. F. Richards, C. Jones, Organometallics 2011, 30, 5543–5550.
- 13Kristallstrukturanalysen (Oxford-Excalibur-2 Diffraktometer): Die Strukturlösung und Verfeinerung wurde mit den Progammen SHELXS-86 und SHELXL-97 durchgeführt: G. M. Sheldrick, SHELXS-97, Program for the Solution of Crystal Structures, Universität Göttingen, 1997; G. M. Sheldrick, SHELXL-97, Program for Crystal Structure Refinement, Universität Göttingen, 1997.
- 13a1: C58H82Ga2Ge2N4, M=1119.90, monoklin, Raumgruppe C2/c, a=24.2323(10) Å, b=15.2254(8) Å, c=15.0722(8) Å, β=94.492(4)°, V=5543.8(5) Å3, Z=4, ρber.=1.342 g cm−3, T=110(2) K, F(000)=2336, μ(MoKα)=2.075 mm−1, prismatischer Kristall, 30770 gemessene Reflexe, 4869 eindeutig (Rint=0.1312), 303 Parameter, R1=0.0564 (I>2σ(I)), wR2=0.1024 (I>2σ(I)), GOF=1.026. Die Qualität der Daten ist begrenzt, was durch den R(int)-Wert von 0.1312 verdeutlicht wird. Der verwendete Kristall war klein und lieferte nur schwache Reflexe. Es wurde keine Zeitabhängigkeit der Qualität der Daten während der Messung beobachtet. Alle Versuche, bessere Kristalle zu erhalten, waren erfolglos.
- 13b2: C64H87FGa2Ge4N4, M=1361.18, trigonal, Raumgruppe P3121, a=19.5740(3) Å, c=15.2771(3) Å, V=5069.10(15) Å3, Z=3, ρber.=1.338 g cm−3, T=110(2) K, F(000)=2094, μ(MoKα)=2.583 mm−1, prismatischer Kristall, 10993 gemessene Reflexe, 6540 einzigartig (Rint=0.0203), 307 Parameter, R1=0.0295 (I>2σ(I)), wR2=0.0812 (I>2σ(I)), GOF=1.034. Das ungeordnete Lösungsmolekül in 2 wurde mit dem Programm Platon 1.13 (SQUEEZE) entfernt: A. L. Spek, Acta Crystallogr. Sect. A 1990, 46, C 34. Das Fluorbenzol-Molekül ist in der empirischen Formel enthalten. CCDC-833302 (1) und -833301 (2) enthalten die ausführlichen kristallographischen Daten zu dieser Veröffentlichung. Die Daten sind kostenlos beim Cambridge Crystallographic Data Centre über www.ccdc.cam.ac.uk/data_request/cif erhältlich.
- 14J. S. Kasper, S. M. Richards, Acta Crystallogr. 1964, 17, 752–755.
- 15aA. Schnepf, R. Köppe, Angew. Chem. 2003, 115, 940–942; Angew. Chem. Int. Ed. 2003, 42, 911–913;
- 15bA. F. Richards, H. Hope, P. P. Power, Angew. Chem. 2003, 115, 4205–4208; Angew. Chem. Int. Ed. 2003, 42, 4071–4074.
- 16Y. Peng, H. Fan, H. Zhu, H. W. Roesky, J. Magull, C. E. Hughes, Angew. Chem. 2004, 116, 3525–3527; Angew. Chem. Int. Ed. 2004, 43, 3443–3445.
- 17aDie quantentheoretischen Methoden sind in den Hintergrundinformationen beschrieben.
- 17bDie Ringstruktur von 1 ist auffallend verschieden von seinen NHC-stabilisierten, kettenartigen Kongener LEEL mit einer ausgeprägten Mehrfachbindung zwischen den Hauptgruppenelementen (E=Si, Ge; L=NHC).[1, 2] Das NHGa bevorzugt die Brückenposition, während das NHC terminal gebunden vorliegt. Die NHC- und NHGa-Ligandeneigenschaften sind charakteristisch verschieden, was Konsequenzen für die Ge-Ge-Bindungssituation hat.
- 18V. Jonas, G. Frenking, M. T. Reetz, J. Am. Chem. Soc. 1994, 116, 8741–8753.
- 19R. S. Ghadwal, H. W. Roesky, K. Pröpper, B. Dittrich, S. Klein, G. Frenking, Angew. Chem. 2011, 123, 5486–5490; Angew. Chem. Int. Ed. 2011, 50, 5374–5378.
- 20Ein Gutachter schlug vor, dass der Grund für die Ge-Ge-π-Bindung die etwas größere Elektronegativität des Ge verglichen mit Ga sein könnte. Wir überprüften dies durch Berechnung der Silicium- und Zinn-Homologe von 1 M. Die Elektronegativitäten des Si (1.7) und Sn (1.7) sind kleiner als die des Ga (1.8), jedoch zeigte die Elektronenstruktur der Gruppe-14-Homologe sowohl für Si-Si als auch für Sn-Sn transannulare π-Bindungen.
- 21A. D. Becke, K. E. Edgecombe, J. Chem. Phys. 1990, 92, 5397–5403.
- 22Ein Gutachter schlug vor, dass verwandte Fälle von π-Bindungen zwischen Hauptgruppenelementen in frühen Arbeiten von Passmore[23] und in jüngeren Arbeiten von Bertrand[24a] und Driess diskutiert wurden.[24b] Die Arbeiten von Passmore präsentieren lediglich Skizzen von Lewis-Strukturen für S82+ [23a] und S2I42+,[23b] die nicht als Beweis für π-Bindung ohne σ-Bindung angesehen werden können. Darüber hinaus schlagen die Autoren vor, dass in S2I42+ [23b] π*-Orbitale der S2- und I2-Fragmente so in Wechselwirkung treten, dass die p-Valenzorbitale der Atome entlang der Bindung ausgerichtet sind, was eine σ-Bindung ergibt. Wir möchten darauf hinweisen dass σ und π die Symmetrie von Orbitalen einer Bindung A-B unter Bezug auf eine Fläche angeben, in der diese Bindung liegt. Die π*-π*-Wechselwirkungen, die für die Bindung im S2I42+ [23b] vorgeschlagen wurden, beziehen sich auf Orbitale mit π-Symmetrie in Bezug auf die S2- und I2-Fragmente, während die S-I-Bindung σ-Symmetrie hat. Eine ähnliche Situation wurde in den Arbeiten von Bertrand[24a] und Driess beschrieben.[24b] Die Abbildung 4 in der vorigen Arbeit zeigt sehr schön auf, wie zwei P-P-π*-Orbitale von dreigliedrigen cyclischen Fragmenten eine P-P-σ-Bindung ergeben. Gleiches gilt für die von Driess[24b] beschriebenen verwandten Verbindungen, bei denen zwei S-S-π*-Orbitale von dreigliedrigen cyclischen Fragmenten S-S-σ-Bindungen ergeben.
- 23aC. G. Davies, R. J. Gillespie, J. J. Park, J. Passmore, Inorg. Chem. 1971, 10, 2781–2785;
- 23bJ. Passmore, G. Sutherland, T. Whidden, P. S. White, J. Chem. Soc. Chem. Commun. 1980, 289–290.
- 24
- 24aY. Canac, D. Bourissou, A. Baceiredo, H. Gornitzka, W. W. Schoeller, G. Bertrand, Science 1998, 279, 2080–2082;
- 24bS. Yao, C. Milsmann, E. Bill, K. Wieghardt, M. Driess, J. Am. Chem. Soc. 2008, 130, 13536–13537.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.