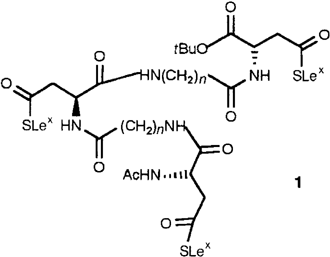
Chemo-enzymatische Synthese von Sialyl-Lewisx-Glycopeptiden†
Gabi Baisch
CIBA Zentrale Forschungslaboratorien Schwarzwaldallee 211, CH–4002 Basel (Schweiz) Telefax: Int. + 61/6978975
Search for more papers by this authorCorresponding Author
Dr. Reinhold Öhrlein
CIBA Zentrale Forschungslaboratorien Schwarzwaldallee 211, CH–4002 Basel (Schweiz) Telefax: Int. + 61/6978975
CIBA Zentrale Forschungslaboratorien Schwarzwaldallee 211, CH–4002 Basel (Schweiz) Telefax: Int. + 61/6978975Search for more papers by this authorGabi Baisch
CIBA Zentrale Forschungslaboratorien Schwarzwaldallee 211, CH–4002 Basel (Schweiz) Telefax: Int. + 61/6978975
Search for more papers by this authorCorresponding Author
Dr. Reinhold Öhrlein
CIBA Zentrale Forschungslaboratorien Schwarzwaldallee 211, CH–4002 Basel (Schweiz) Telefax: Int. + 61/6978975
CIBA Zentrale Forschungslaboratorien Schwarzwaldallee 211, CH–4002 Basel (Schweiz) Telefax: Int. + 61/6978975Search for more papers by this authorDie Autoren danken Dr. A. Katopodis und Dr. M. Streiff für die Bereitstellung von biotechnologisch erzeugter α(2–3)Sialyltransferase und Fucosyltransferase VI.
Abstract
References
- 1 J. B. Lowe in Molecular Glycobiology (Hrsg.: M. Fukda, O. Hindsgaul), IRL- Press, 1994, S. 163, zit. Lit.
- 2 M. B. Lawrence, T. A. Springer, Cell 1991, 65, 859.
- 3 K. Ley, P. Gaethgens, C. Fennie, M. S. Singer, L. A. Lasky, S. D. Rosen, Blood, 1991, 77, 2553.
- 4 L. A. Lasky, Ann. Rev. Biochem. 1995, 64, 113.
- 5 C. R. Bertozzi, Chem. Biol. 1995, 2, 703.
- 6 M. Edwards, Curr. Opin. Therap. Pat. 1991, 1617.
- 7 R. M. Nelson, S. Dolich, A. Aruffo, O. Cecconi, M. P. Bevilaqua, J. Clin. Invest. 1993, 91, 1157.
- 8 T. Feizi, Curr. Opin. Struct. Biol. 1993, 3, 701.
- 9 J. K. Welply, S. Z. Abbas, P. Scudder, J. L. Keene, K. Broschat, S. Casnocha, C. Gorka, C. Steiniger, S. C. Howard, J. J. Schmuke, M. Graneto, J. M. Rotseart, J. D. Manger, G. S. Jacob, Glycobiology 1994, 4, 259.
- 10 G. Kretzschmar, U. Sprengard, H. Kunz, E. Bartnik, W. Schmidt, A. Töpfer, B. Hörsch, M. Kranse, D. Seiffge, Tetrahedron 1995, 51, 13015.
- 11
Nach Einreichen unserer Arbeit wurde die Synthese eines trivalenten SLex-Konjugates an einem Cyclopeptidtemplat publiziert:
U. Sprengard,
M. Schudok,
W. Schmidt,
G. Kretzschmar,
H. Kunz,
Angew. Chem.
1996,
108,
359;
10.1002/ange.19961080324 Google ScholarAngew. Chem. Int. Ed. Engl. 1996, 35, 321.
- 12 S. A. DeFrees, W. Kosch, W. Way, J. C. Paulson, S. Sabesan, R. R. Halcomb, D.-H. Huang, Y. Ichikawa, C.-H. Wong, J. Am. Chem. Soc. 1995, 117, 66.
- 13 H. Benz, Synthesis 1994, 337.
- 14 C. Unverzagt, S. Kelm, J. C. Paulson, Carbohydr. Res. 1994, 251, 285.
- 15 C.-H. Wong, R. R. Halcomb, Y. Ichikawa, T. Kajimoto, Angew. Chem. 1995, 107, 569; Angew. Chem. Int. Ed. Engl. 1995, 34, 521.
- 16 O. Hindsgaul, Sem. Cell Biol. 1991, 2, 319.
- 17 K. von dem Bruch H. Kunz, Angew. Chem. 1994, 106, 87; Angew. Chem. Int. Ed. Engl. 1994, 33, 101.
- 18 Die cDNA-Sequenzen einer sehr großen Zahl von Transferasen sind hinterlegt, und meist lassen sich Zellclone, die die gewünschte Transferase exprimieren, erhalten; siehe hierzu M. C. Field, L. J. Wainwright, Glycobiology 1995, 5, 463.
- 19 J. E. Heidlas, K. J. Williams, G. M. Whitesides, Acc. Chem. Res. 1992, 25, 307.
- 20 Y. Ichikawa, J. L. Liu, G.-J. Shen, C.-H. Wong, J. Am. Chem. Soc. 1991, 113, 6300.
- 21 T. Inazu, K. Kobayashi, Synlett 1993, 869.
- 22 P. Schultheiß-Reimann, H. Kunz, Angew. Chem. 1983, 95, 64; Angew. Chem. Int. Ed. Engl. 1983, 22, 62.
- 23 D. Seghal, I. K. Vijay, Anal. Biochem. 1994, 218, 87.
- 24 S. Chen, J. Xu, Tetrahedron Lett. 1992, 33, 647.
- 25 Die Verbindungen 1–5 können leicht in 1H-NMR-spektroskopisch reiner Form über Kieselgelchromatographie im Grammaßstab erhalten werden. Die Substanzen 6 und 7 werden durch Chromatographie über RP-18-Gel in 100–250 mg Mengen rein erhalten.
- 26 J. E. Heidlas, W. J. Lees, G. M. Whitesides, J. Org. Chem. 1992, 57, 152; kommerziell erhältlich von Sigma (U-4500).
- 27 Sigma G-5507.
- 28 Boehringer Nr. 108146.
- 29 M. M. Palcic, Methods Enzymol. 1994, 230, 300.
- 30 M. Kittelmann, T. Klein, U. Kragl, C. Wandrey, O. Ghisalba, Appl. Microbiol. Biotechnol. 1995, 44, 59.
- 31 S. Gosselin, M. Alhussaini, M. Streiff, K. Takabayashi, M. M. Palcic, Anal. Biochem. 1994, 220, 92.
- 32 U. B. Gokhale, O. Hindsgaul, M. M. Palcic, Can. J. Chem. 1990, 68, 1063: Grammengen dieses aktivierten Donors sowie mehrere Derivate lassen sich auch leicht chemo-enzymatisch herstellen: R. Öhrlein, G. Baisch, noch unveröffentlicht.
- 33 Lösliche Fucosyltransferase VI wurde aus dem Überstand einer hochproduktiven, transfizierten CHO-Zellinie isoliert: A. Katopodis, B. Bowen, noch unveröffentlicht.
- 34 Die Inhibierungskonstanten (IC50) wurden über einen statischen Assay mit recombinantem menschlichem E-Selectin gewonnen. Die Untersuchungen wurden von Dr. J. Magnani (Glyco Tech Corp., 14915 Broschart Rd., Rockville, MD 20850, USA) durchgeführt.
- 35 Diese äußerst empfindliche und schonende Methode wurde ursprünglich für die Analytik von Oligonucleotiden entwickelt (U. Pieles, W. Zürcher, M. Schär, H. E. Moser, Nucleic Acids Res. 1993, 21, 3191). Wir konnten sie aber auch sehr zuverlässig zum Nachweis komplexer Glycopeptide anwenden.
- 36 Auswahl von 1H-NMR-Daten (D2O, 500 MHz, interner Standard D2O, 4.80 ppm): 8 (n = 4): δ = 1.27 (d, J = 7.0 Hz, 6 H, 6-H (fue)), 1.54 und 1.68 (jeweils m und 2 H, O2CCH2CH2CH2CH2N), 1.76 (t, J = 11 Hz, 2 H, 3-Hax (sia)), 1.94 und 1.96 (jeweils s und 3 H, NHAc), 2.00 (s, 9 H, NHAc), 2.25 (m, 2 H, O2CCH2CH2CH2CH2N), 2.75 (m, 6 H, 3-Häq (sia) und β-H (asn)), 3.15 (m, 2 H, O2CCH2CH2CH2CH2N), 4.49 (d, J = 7.5 Hz, 1 H, 1-H (gal)), 4.51 (d, J = 7.5 Hz, 1 H, 1-H (gal)), 4.60 (m, 2 H, α-H (asn)), 5.14 (m, 4 H, 1-H (fuc) und 1-H″ (glcNAc)). - 9 (n = 4): δ = 1.31 (d, J = 7.0 Hz, 9 H, 6-H (fuc)), 1.68 (m, 8 H, O2CCH2CH2CH2CH2N), 1.94 (t, J = 11 Hz, 3 H, 3-Hax (sia)), 2.15 (s, 9 H, NHAc), 2.20 (s, 12 H, NHAc), 2.46 (m, 4 H, O2CCH2CH2CH2CH2N), 2.92 (m, 9 H, 3-Häq (sia) und β-H (asn)), 3.48 (m, 4 H, O2CCH2CH2CH2CH2N), 4.71 (d, J = 7.5 Hz, 3 H, 1-H (gal)), 4.79 (m, 3 H, α-H (asn)), 5.25 (m, 6 H, 1-H (fuc) und 1-H (glcNAc).
- 37 Kürzlich konnten wir zeigen, daß die hier verwendeten Transferasen eine ganze Reihe nichtnatürlicher Acceptoren bereitwillig in vitro umsetzen: G. Baisch, R. Öhrlein, B. Ernst, Biorg. Med. Chem. Lett. 1996, im Druck; G. Baisch, R. Öhrlein, B. Ernst, M. Streiff, Biorg. Med. Chem. Lett. im Druck; G. Baisch, R. Öhrlein, B. Ernst, A. Katopodis, Biorg. Med. Chem. Lett. im Druck.
- 38 Eine aktuelle Übersicht findet sich in: M. M. Palcic, O. Hindsgaul, Trends Glycosci, Glycotechnol. 1996, 8, 37.
- 39 L. Yu, R. Cabrera, J. Ramirez, V. A. Malinoskii, K. Brew, P. G. Wang, Tetrahedron Lett. 1995, 36, 2897; C.-H. Wong, Y. Ichikawa, T. Krach, C. Gauthron-LeNarvor, D. P. Dumas, G. C. Look, J. Am. Chem. Soc. 1991, 113, 8137; R. Öhrlein, noch unveröffentlicht.
- 40 N. M. Allanson, A. H. Davidson, C. D. Floyd, F. M. Martin, Tetrahedron: Asymmetry 1994, 5, 2061; A. Töpfer, G. Kretzschmar, E. Bartnik, Tetrahedron Lett. 1995, 36, 9161.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.